- Nustatyti Mg 3 N 2, visiškai suskaidyto vandeniu, masę, jei druskai susidaryti su hidrolizės produktais reikia 150 ml 4% tirpalo. druskos rūgšties tankis 1,02 g/ml.
Rodyti 1) Mg3N2 + 6H2O → 3Mg (OH)2 + 2NH3
2) Mg(OH) 2 + 2HCl → MgCl 2 + 2H 2 O
3) NH 3 + HCl → NH 4 Cl
n (HCl) \u003d 150 * 1,02 * 0,04 / 36,5 \u003d 0,168 mol
Leiskite x mol Mg 3 N 2 reaguoti. Pagal 1 lygtį susidarė 3x mol Mg(OH) 2 ir 2x mol NH 3. Norint neutralizuoti 3x mol Mg(OH) 2, reikėjo 6x mol HCl (pagal 2 lygtį), o neutralizuojant 2x mol NH 3 - 2x mol HCl (pagal 3 lygtį), iš viso 8x mol HCl. .
8 x \u003d 0,168 mol,
X \u003d 0,021 mol,
n (Mg 3 N 2) \u003d 0,021 mol,
m (Mg 3 N 2) \u003d M * n = 100 * 0,021 \u003d 2,1 g.
Atsakymas: 2,1 g - Nustatoma natrio karbonato masės dalis tirpale, gautame virinant 150 g 8,4 % natrio bikarbonato tirpalo. Koks tūris 15,6% bario chlorido tirpalo (tankis 1,11 g / ml) sureaguos su gautu natrio karbonatu? Galima nepaisyti vandens išgaravimo.
Rodyti 1) 2NaHCO 3 - t → Na 2 CO 3 + H 2 O + CO 2
2) Na 2 CO 3 + BaCl 2 → BaCO 3 + 2 NaCl
n (NaHCO 3) \u003d 150 * 0,084 / 84 \u003d 0,15 mol
Iš (1) lygties n (NaHCO 3) : n (Na 2 CO 3) = 2:1 => n (Na 2 CO 3) = 0,075 mol.
m (Na 2 CO 3) \u003d 0,075 ∙ 106 \u003d 7,95 g
n (CO 2) \u003d 0,075 mol, m (CO 2) \u003d 0,075 ∙ 44 \u003d 3,3 g
m (tirpalas) \u003d 150 - 3,3 \u003d 146,7 g
ω (Na 2 CO 3) \u003d m (Na 2 CO 3) / m (tirpalas) \u003d 7,95 / 146,7 \u003d 0,0542 arba 5,42 %
Iš (2) lygties n (Na 2 CO 3) : n (BaCl 2) = 1: 1 => n (BaCl 2) = 0,075 mol.
m (BaCl 2) \u003d n * M = 0,075 * 208 \u003d 15,6 g.
m (tirpalas) \u003d m (BaCl 2) / ω \u003d 15,6 / 0,156 \u003d 100 g
V (tirpalas) \u003d m (tirpalas) / ρ \u003d 100 / 1,11 \u003d 90,1 ml.
Atsakymas: 5,42%, 90,1 ml. - Kokiais masių santykiais reikia sumaišyti 10 % natrio hidroksido ir sieros rūgšties tirpalus, kad gautųsi neutralus natrio sulfato tirpalas? Kokia yra druskos masės dalis šiame tirpale?
Rodyti 2NaOH + H2SO4 → Na2SO4 + 2H2O
Tegul NaOH tirpalo masė yra 100 g, m(NaOH)= 10 g,
n(NaOH) = 0,25 mol,
n(H2SO4) = 0,125 mol,
m (H 2 SO 4) \u003d 12,25 g,
m (H 2 SO 4 tirpalas) = 122,5 g
Santykis m (NaOH tirpalas) : m (H 2 SO 4 tirpalas) = 1:1,2
n(Na2SO4) = 0,125 mol,
m (Na 2 SO 4) \u003d 17,75 g,
m (tirpalas) \u003d 100 + 122,5 g \u003d 222,5 g,
w(Na 2 SO 4) = 7,98 % - Kiek litrų chloro (N.O.) išsiskirs, jei kaitinant į 200 ml 35% druskos rūgšties (tankis 1,17 g/ml) įpilama 26,1 g mangano (IV) oksido? Kiek gramų natrio hidroksido šaltame tirpale sureaguos su tokiu chloro kiekiu?
Rodyti 1) MnO 2 + 4 HCl → MnCl 2 + 2 H 2 O + Cl 2
2) 2NaOH + Cl 2 → NaCl + NaClO + H 2 O
n (HCl) \u003d 200 * 1,17 * 0,35 / 36,5 \u003d 2,24 mol - perteklius
n (MnO 2) \u003d 26,1 / 87 \u003d 0,3 mol - trūksta
Pagal (1) lygtį n (Cl 2) \u003d 0,3 mol
V (Cl 2) \u003d 6,72 l
Pagal (2) lygtį n(NaOH)= 0,6 mol, m(NaOH)=24 g
Atsakymas: 6,72 l, 24 g - Kokiame vandens tūryje reikia ištirpinti 11,2 litro sieros oksido (IV) (n.a.), kad gautųsi sieros rūgšties tirpalas, kurio masės dalis yra 1 %? Kokią spalvą įgaus lakmusas, įpylus jo į gautą tirpalą?
- Kokią masę ličio hidrido reikia ištirpinti 100 ml vandens, kad būtų gautas tirpalas, kurio hidroksido masės dalis yra 5%? Kokią spalvą įgaus lakmusas, įpylus jo į gautą tirpalą?
Rodyti LiH + H2O → LiOH + H2
Tegul m (LiH) = x g, tada m (LiOH) = x * 24/8 = 3 x g.
m (tirpalas) \u003d m (H 2 O) + m (LiH) - m (H 2)
m (r-ra) \u003d x + 100 - x / 4 \u003d 0,75x + 100
w \u003d m (in-va) * 100 % / m (r-ra)
3x/(0,75x+100) = 0,05
3x=0,038x+5
2,96x = 5
x = 1,7 g - Kokioje masėje tirpalo, kurio Na 2 SO 4 masės dalis yra 10 %, reikia ištirpinti 200 g Na 2 SO 4 × 10H 2 O, kad būtų gautas tirpalas, kurio natrio sulfato masės dalis yra 16 %? Kokią terpę turės gautas tirpalas?
Rodyti Tegul tirpalo masė x g. Jame yra 0,1 x g Na 2 SO 4.
Įpilta 200 g kristalinio hidrato, kuriame natrio sulfato masė 200*142/322=88,2 g.
(0,1 x +88,2) / (x + 200) \u003d 0,16
0,1x +88,2 = 0,16x + 32
0,06x = 56,2
x = 937
Atsakymas: 937 g, neutralus. - Dujinis amoniakas, išsiskyręs verdant 160 g 7% kalio hidroksido tirpalo su 9,0 g amonio chlorido, buvo ištirpintas 75 g vandens. Nustatykite amoniako masės dalį gautame tirpale.
- Amoniakas, išsiskyręs verdant 80 g 14 % kalio hidroksido tirpalo su 8,03 g amonio chlorido, ištirpo vandenyje. Apskaičiuokite, kiek mililitrų 5% azoto rūgšties, kurios tankis 1,02 g / ml, bus sunaudota gautam amoniako tirpalui neutralizuoti.
Rodyti KOH + NH 4 Cl → NH 3 + H 2 O + KCl
NH 3 + HNO 3 → NH 4 NO 3
n (NH 4 Cl) \u003d 8,03 / 53,5 \u003d 0,15 mol
m (KOH) \u003d 80 * 0,14 \u003d 11,2 g
n (KOH) \u003d 11,2 / 56 \u003d 0,2 mol
KOH yra perteklius.
Tolesni skaičiavimai atliekami pagal trūkumą
n (NH 4 Cl) \u003d n (NH 3) \u003d 0,15 mol
n (HNO 3) \u003d 0,15 mol
m (HNO 3) \u003d n * M = 0,15 * 63 \u003d 9,45 g
m (p-ra HNO 3) \u003d m (in-va) * 100% / w \u003d 9,45 / 0,05 \u003d 189 g
m = V*ρ
V = m / ρ = 189 / 1,02 = 185,3 ml
Atsakymas: 185,3 ml - Kalcio karbidas, apdorotas vandens pertekliumi. Išsiskyrusios dujos užėmė 4,48 litro tūrį (N.O.). Apskaičiuokite, koks tūris 20% druskos rūgšties, kurios tankis yra 1,10 g / ml, bus naudojamas visiškai neutralizuoti iš kalcio karbido susidariusį šarmą.
Rodyti 1) CaC 2 + 2H 2 O \u003d Ca (OH) 2 + C 2 H 2
n (C 2 H 2) \u003d V / V m \u003d 4,48 / 22,4 \u003d 0,2 mol
Iš (1) lygties => n(C 2 H 2) = n(Ca(OH) 2)
n (Ca (OH) 2) \u003d 0,2 mol
2) Ca (OH) 2 + 2HCl \u003d CaCl 2 + 2H 2 O
Iš (2) lygties => n(Ca(OH) 2) : n(HCl) = 1:2 => n(HCl) = 0,4 mol
m(HCl) \u003d n * M = 0,4 * 36,5 \u003d 14,6 g
m (HCl tirpalas) \u003d 14,6 / 0,2 \u003d 73 g
V (HCl tirpalas) = 73/1,1 = 66,4 ml - Apskaičiuokite, koks tūris 10% vandenilio chlorido tirpalo, kurio tankis 1,05 g/ml, bus naudojamas visiškai neutralizuoti kalcio karbido hidrolizės metu susidariusį kalcio hidroksidą, jei hidrolizės metu išsiskiriančios dujos užima 8,96 l (n.o.) tūrį. .
Rodyti CaC 2 + 2 H 2 O → Ca (OH) 2 + C 2 H 2
Ca(OH) 2 + 2 HCl → CaCl 2 + 2 H 2 O
n(C 2 H 2) = V / V n.o.s. = 8,96 / 22,4 = 0,4 mol
n (C 2 H 2) \u003d n Ca (OH) 2 \u003d 0,4 mol
n(HCl) = 0,4 * 2 = 0,8 mol
m (HCl) \u003d n * M = 0,8 * 36,5 \u003d 29,2 g
w \u003d m (in-va) * 100 % / m (r-ra)
m (tirpalas) \u003d m (in-va) * 100% / w \u003d 29,2 / 0,1 \u003d 292 g
m = V*ρ
V= m / ρ = 292 / 1,05 = 278 ml
Atsakymas: 278 ml - Aliuminio karbidas, apdorotas 200 g 30% sieros rūgšties tirpalo. Tuo pačiu metu išsiskyręs metanas užėmė 4,48 l (n.o.) tūrį. Apskaičiuokite sieros rūgšties masės dalį gautame tirpale.
Rodyti Al 4 C 3 + 6H 2 SO 4 → 2Al 2 (SO 4) 3 + 3CH 4
n(CH 4) \u003d V / Vm \u003d 4,48 / 22,4 \u003d 0,2 mol
m (CH 4) \u003d m * M = 0,2 * 16 \u003d 3,2 g
m (Al 4 C 3) \u003d 1/3 * 0,2 * 144 \u003d 9,6 g
Reagavo pagal lygtį n (H 2 SO 4) \u003d 0,4 mol,
m (H 2 SO 4) \u003d 0,4 * 98 \u003d 39,2 g.
Iš pradžių buvo pridėta m (H 2 SO 4) = m (p-ra) * ω = 200 g * 0,3 = 60 g. Liko m (H 2 SO 4) = 60 - 39,2 = 20,8 g.
m (H 2 SO 4) \u003d 0,21 * 98 \u003d 20,8 g
m (p-pa) \u003d m (Al 4 C 3) + m (p-pa H 2 SO 4) - m (CH 4)
m(p-pa) = 9,6 g + 200 g - 3,2 g = 206,4 g
ω (H 2 SO 4) \u003d m (H 2 SO 4) / m (tirpalas) \u003d 20,8 / 206,4 * 100 % \u003d 10 % - Aliuminio karbidą apdorojant druskos rūgšties tirpalu, kurio masė 320 g, o HCl masės dalis 22%, išsiskyrė 6,72 l (n.o.) metano. Apskaičiuokite druskos rūgšties masės dalį gautame tirpale.
Rodyti Al 4 C 3 + 12HCl → 4AlCl 3 + 3CH 4 n (CH 4) \u003d V / Vm \u003d b,72 / 22,4 \u003d 0,3 mol;
Pagal lygtį n (HCl) \u003d 4 n (CH 4) \u003d 1,2 mol
m (HCl) \u003d m (tirpalas) * ω \u003d 320 0,22 \u003d 70,4 g;
Sureagavo m (HCl) \u003d 1,2 36,5 \u003d 43,8 g.
Likęs m(HCl) = 70,4 - 43,8 = 26,6 g.
m (p-pa) \u003d 320 g + m (Al 4 C 3) - m (CH 4),
Pagal lygtį n (Al 4 C 3) \u003d 1/3 n (CH 4) \u003d 0,1 mol;
m (Al 4 C 3) \u003d 0,1 144 \u003d 14,4 g,
m(CH 4) \u003d 0,3 16 \u003d 4,8 g,
m(p-pa) \u003d 320 g + 14,4 g - 4,8 g \u003d 329,6 g.
ω(HCl) = 26,6 / 329,6 100 % = 8,07 % - Kalcio hidrido buvo pridėta prie druskos rūgšties tirpalo pertekliaus (rūgšties tirpalo masė 150 g, HCl masės dalis 20%). Šiuo atveju buvo išleista 6,72 l (N.O.) vandenilio. Apskaičiuokite kalcio chlorido masės dalį gautame tirpale.
Rodyti n (CaCl 2) \u003d ½ n (H 2) \u003d 0,15 mol
m (CaCl 2) \u003d 111 * 0,15 \u003d 16,65 g
W (CaCl 2) \u003d m in-va / m tirpalas \u003d 16,65 / 155,7 \u003d 0,1069 arba 10,69%
Atsakymas: W (CaCl 2) \u003d 10,69 % - Sumaišyta 125 ml 5 % ličio hidroksido tirpalo (r = 1,05 g/ml) ir 100 ml 5 % azoto rūgšties tirpalo (ρ = 1,03 g/ml). Nustatykite gauto tirpalo terpę ir ličio nitrato masės dalį joje.
Rodyti LiOH + HNO₃ = LiNO₃ + H2O
m (LiOH tirpalas) = V × ρ = 125 ml × 1,05 g/ml = 131,25 g
m(LiOH) = 131,25 g × 0,05 = 6,563 g
n(LiOH) \u003d m / M \u003d 6,563 / 24 \u003d 0,273 mol
m (HNO₃ tirpalas:) = V × ρ = 100 ml × 1,03 g/ml = 103 g
m(HNO3) = 103 g × 0,05 = 5,15 g
n(HNO3) = 5,15 / 63 = 0,0817 mol
LiOH pateiktas perteklius, skaičiuojama remiantis rūgštimi.
n(LiNO3) = 0,0817 mol
m (LiNO₃) = n × M = 0,0817 × 69 = 5,64 g
m (gautas tirpalas) \u003d m (LiOH tirpalas) + m (HNO₃ tirpalas) \u003d 131,25 g + 103 g \u003d 234,25 g
ω(LiNO₃) = 5,64 / 234,25 × 100 % = 2,4 %
Atsakymas: šarminis, 2,4%; - Fosforo (V) oksidas, sveriantis 1,42 g, ištirpintas 60 g 8,2 % ortofosforo rūgšties ir gautas tirpalas virinamas. Kokia druska ir koks kiekis susidaro, jei į gautą tirpalą įpilama 3,92 g kalio hidroksido?
- Sieros oksidas (VI), sveriantis 8 g, buvo ištirpintas 110 g 8% sieros rūgšties. Kokia druska ir koks kiekis susidaro, jei į gautą tirpalą įpilama 10,6 g kalio hidroksido?
Rodyti SO 3 + H 2 O \u003d H 2 SO 4
n \u003d m / MM (SO 3) \u003d 80 g / mol,
n(SO 3) \u003d 8/80 \u003d 0,1 mol.
Pagal (1) lygtį n (H 2 SO 4) \u003d n (SO 3) \u003d 0,1 mol,
n(KOH)=10,6/56=0,19 mol.
Pradiniame tirpale n (H 2 SO 4) \u003d 110 * 0,08 / 98 \u003d 0,09 mol.
Pridėjus sieros oksido n (H 2 SO 4) \u003d 0,09 + 0,1 \u003d 0,19 mol.
Šarmų ir rūgšties santykis yra 1:1, vadinasi, susidaro rūgšties druska.
H 2 SO 4 + KOH \u003d KHSO 4 + H 2 O
n (H 2 SO 4) \u003d n (KOH) \u003d n (KHSO 4) \u003d 0,19 mol
Atsakymas: KHSO 4, 0,19 mol. - Amoniakas, išsiskyręs sąveikaujant 107 g 20 % amonio chlorido tirpalo su 150 g 18 % natrio hidroksido tirpalu, visiškai sureagavo su 60 % fosforo rūgštimi ir susidarė amonio-divandenilio fosfatas. Nustatoma natrio chlorido masės dalis tirpale ir reikiama 60 % fosforo rūgšties tirpalo masė.
Rodyti NH 4 Cl + NaOH = NaCl + NH 3 + H 2 O
m(NH 4 Cl) \u003d 107 g ∙ 0,2 \u003d 21,4 g
n (NH 4 Cl) \u003d 21,4 g / 53,5 g / mol \u003d 0,4 mol
m(NaOH) = 150 g ∙ 0,18 = 27 g
n(NaOH) = 27 g / 40 g / mol = 0,675 mol, todėl NaOH yra perteklius
n(NaCl) = n(NH4Cl) = 0,4 mol
m(NaCl) = 0,4 ∙ 58,5 = 23,4 g
n (NH 3) \u003d n (NH 4 Cl) \u003d 0,4 mol
m (NH 3) \u003d 0,4 ∙ 17 \u003d 6,8 g
m (tirpalas) \u003d m (tirpalas NH 4 Cl) + m (tirpalas NaOH) - m (NH 3) \u003d 107 + 150 - 6,8 \u003d 250,2 g
w(NaCl) = 23,4 / 250,2 = 0,094 arba 9,4 %
NH 3 + H 3 PO 4 \u003d NH 4 H 2 PO 4
n (NH 3) \u003d n (H 3 PO 4) \u003d 0,4 mol
m (H 3 PO 4) \u003d 98 ∙ 0,4 \u003d 39,2 g
m (H 3 PO 4 tirpalas) \u003d 39,2 / 0,6 \u003d 65,3 g - Vandenilio sulfidas, išsiskyręs sąveikaujant koncentruotos sieros rūgšties pertekliui su 1,44 g magnio, buvo praleistas per 160 g 1,5% bromo tirpalo. Nustatykite šiuo atveju susidariusių nuosėdų masę ir rūgšties masės dalį gautame tirpale.
Rodyti 4Mg + 5H2SO4 \u003d 4MgSO4 + H2S + 4H2O
H 2 S + Br 2 \u003d 2HBr + S ↓
n(Mg) \u003d m / M \u003d 1,44 g: 24 g / mol \u003d 0,06 mol
n(H2S) = ¼ n(Mg) = 0,015 mol
m (H 2 S) \u003d n * M = 0,015 mol * 34 g / mol \u003d 0,51 mol
m (in-va Br 2) \u003d 160 g * 0,015 \u003d 2,4 g
n(Br 2) \u003d m / M \u003d 2,4 g: 160 g / mol \u003d 0,015 mol
n (HBr) \u003d 2n (Br 2) \u003d 0,03 mol
m(HBr) \u003d n * M = 0,03 mol * 81 g / mol \u003d 2,43 g
n(S) \u003d n (Br 2) \u003d 0,015 mol
m(S) = n * M = 0,015 mol * 32 g/mol = 0,48 g
m (tirpalas) \u003d m (H 2 S) + m (tirpalas Br 2) -m (S) \u003d 0,51 g + 160 g - 0,48 \u003d 160,03 g
W (HBr) \u003d m (HBr) / m (tirpalas) = 2,43 g / 160,03 g \u003d 0,015 arba 1,5 %
Atsakymas: m (S) \u003d 0,48 g, w (HBr) \u003d 1,5 % - Chloras be likučių reagavo su 228,58 ml 5% NaOH tirpalo (tankis 1,05 g/ml) aukštesnėje temperatūroje. Nustatykite gauto tirpalo sudėtį ir apskaičiuokite medžiagų masės dalis šiame tirpale.
Rodyti 6NaOH + 3Cl2 = 5NaCl + NaClO3 + 3H 2O (esant t)
m tirpalas \u003d 228,58 ∙ 1,05 \u003d 240 g;
m(NaOH) \u003d 240 ∙ 0,05 \u003d 12g.
n(NaOH) = 12/40 = 0,3 mol;
n(Cl2) = 0,15 mol;
n(NaCl) = 0,25 mol;
n(NaClO 3) = 0,05 mol
m (NaCl) \u003d 58,5 ∙ 0,25 \u003d 14,625 g;
m (NaClO 3) \u003d 106,5 ∙ 0,05 \u003d 5,325 g:
m tirpalas \u003d 240 + m (Cl 2) \u003d 240 + 71 ∙ 0,15 \u003d 240 + 10,65 \u003d 250,65 g
W(NaCl) = 14,625 / 250,65 = 0,0583 arba 5,83 %
W (NaClO 3) \u003d 5,325 / 250,65 \u003d 0,0212 arba 2,12 % - Varis, sveriantis 6,4 g, buvo apdorotas 100 ml 30 % azoto rūgšties (ρ = 1,153 g/ml). Kad produktai būtų visiškai surišti, į gautą tirpalą įpilama 200 g natrio hidroksido tirpalo. Nustatykite šarmo masės dalį panaudotame tirpale.
Rodyti 3Cu + 8HNO 3 \u003d 3Cu (NO 3) 2 + 2NO + 4H 2 O
m (HNO 3) \u003d 100 ∙ 0,3 ∙ 1,153 \u003d 34,59 g
n(HNO3) = 34,59/63 = 0,55 mol, n(Cu) = 6,4/64 = 0,1 mol
n (HNO 3) g = 0,55 - 8/3 ∙ 0,1 = 0,28 mol
Cu (NO 3) 2 + 2 NaOH \u003d Cu (OH) 2 + 2 NaNO 3
HNO 3 + NaOH \u003d NaNO 3 + H 2 O
n(NaOH) \u003d n (HNO 3) g + 2n (Cu (NO 3) 2) \u003d 0,28 + 0,1 ∙ 2 \u003d 0,48 mol
m (NaOH) \u003d 0,48 ∙ 40 \u003d 19,2 g.
W(NaOH) = 19,2 / 200 = 0,096 arba 9,6 % - 60 g 18 % ortofosforo rūgšties ištirpinta 2,84 g fosforo (V) oksido ir gautas tirpalas užvirinamas. Kokia druska ir koks kiekis susidaro, jei į gautą tirpalą įpilama 30 g natrio hidroksido?
Rodyti 1) 3H2O + P2O5 → 2H3PO4
Pradiniame tirpale m (H 3 PO 4) \u003d m (tirpalas) * ω \u003d 60 * 0,18 \u003d 10,8 g.
n(P2O5) = m/M = 2,84/142 = 0,02 mol
Dėl reakcijos susidarė m (H 3 PO 4) \u003d 0,04 * 98 \u003d 3,92 g
Bendras m (H 3 PO 4) \u003d 3,92 + 10,8 \u003d 14,72 g.
n (H 3 PO 4) \u003d m / M \u003d 14,72 / 98 \u003d 0,15 mol
n (NaOH) \u003d m / M \u003d 30/40 \u003d 0,75 mol - perteklius, druska yra vidutinė.
2) 3NaOH + H3PO4 → Na3PO4 + 3H2O
Pagal (2) lygtį n (Na 3 PO 4) \u003d n (H 3 PO 4) \u003d 0,15 mol
m (Na 3 PO 4) \u003d 0,15 * 164 \u003d 24,6 g
Atsakymas: 24,6 g - Per 200 g 4,9% fosforo rūgšties tirpalo buvo praleidžiamas 4,48 l (n.o.) tūrio amoniakas. Pavadinkite druskos, susidariusios reakcijos metu, pavadinimą ir nustatykite jos masę.
- 5,6 l (n.o.) vandenilio sulfido be nuosėdų sureagavo su 59,02 ml 20% KOH tirpalo (tankis 1,186 g/ml). Nustatykite šios cheminės reakcijos metu susidariusios druskos masę.
Rodyti m (p-ra KOH) \u003d V * ρ \u003d 1,186 * 59,02 \u003d 70 g,
m (KOH) \u003d m (p-raKOH) * ω \u003d 70 g * 0,2 \u003d 14 g,
n (KOH) \u003d m / M \u003d 14/56 \u003d 0,25 mol,
n (H 2 S) \u003d V / Vm \u003d 5,6 / 22,4 \u003d 0,25 mol.
Vandenilio sulfido kiekis lygus šarmo kiekiui, todėl susidaro rūgšties druska - hidrosulfidas pagal reakciją: H 2 S + KOH \u003d KHS + H 2 O
Pagal lygtį n(KHS) = 0,25 mol,
m (KHS) \u003d M * n = 72 0,25 \u003d 18 g.
Atsakymas: 18 - 7,6 g skruzdžių ir acto rūgščių mišinio neutralizuoti buvo panaudota 35 ml 20 % kalio hidroksido tirpalo (tankis 1,20 g/ml). Apskaičiuokite acto rūgšties masę ir jos masės dalį pradiniame rūgščių mišinyje.
Rodyti COOH + KOH \u003d NSOOK + H 2 O
CH 3 COOH + KOH \u003d CH 3 COOK + H 2 O
m (p-paKOH) \u003d V (p-pa) * ρ \u003d 35 * 1,2 \u003d 42 g.
m (KOH) \u003d m (p-pa) * ω (KOH) = 42 * 0,2 \u003d 8,4 g
n (KOH) \u003d m (KOH) / M (KOH) \u003d 8,4 / 56 \u003d 0,15 mol
Tegul n (HCOOH) \u003d x mol ir n (CH 3 COOH) \u003d y mol.
m (HCOOH) \u003d n (HCOOH) * M (HCOOH) \u003d x * 46 g
m (CH 3 COOH) \u003d n (CH 3 COOH) * M (CH 3 COOH) \u003d y * 60 g
Sudarykime lygčių sistemą:
x + y = 0,15
60m + 46x = 7,6
Išsprendžiame sistemą: x \u003d 0,1 mol, y \u003d 0,05 mol
m (CH 3 COOH) \u003d n (CH 3 COOH) * M (CH 3 COOH) = 0,05 * 60 \u003d 3 g.
ω(CH3COOH) = m(CH3COOH)/m(mišinys) = 3/7,6 = 0,395 arba 39,5%.
Atsakymas: 39,5 proc. - Sumaišyta 100 ml 30 % perchloro rūgšties tirpalo (r = 1,11 g/ml) ir 300 ml 20 % natrio hidroksido tirpalo (r = 1,10 g/ml). Kiek mililitrų vandens reikia įpilti į gautą mišinį, kad natrio perchlorato masės dalis jame būtų 8%?
Rodyti HClO 4 + NaOH = NaClO 4 + H 2 O
m (p-p NaOH) \u003d V * ρ \u003d 300 * 1,10 \u003d 330 g.
n (NaOH) \u003d m (p-p NaOH) * ω / M = 330 * 0,2 / 40 \u003d 1,65 mol - perteklius.
m (HClO 4 tirpalas) \u003d V * ρ \u003d 100 * 1,11 \u003d 111 g.
n (HClO 4) \u003d 111 * 0,3 / 100,5 \u003d 0,331 mol,
Pagal lygtį n (HClO 4) \u003d n (NaClO 4) \u003d 0,331 mol,
m (NaClO 4) \u003d n * M = 0,331 * 122,5 \u003d 40,5 g.
Tegul įpilto vandens masė yra x g.
40,5 / (111 + 330 + x) \u003d 0,08
iš kur x = 65,3 g.
V(H2O)=65,3 ml.
Atsakymas: 65,3 ml - Į 100 ml 5% druskos rūgšties tirpalo (tankis 1,02 g/ml) įpilama 6,4 g kalcio karbido. Kiek mililitrų 15% azoto rūgšties (tankis 1,08 g/ml) reikia įpilti į gautą mišinį, kad jis visiškai neutralizuotų?
Rodyti 1) CaC 2 + 2HCl \u003d CaCl 2 + C 2 H 2
2) CaC 2 + 2H 2 O \u003d Ca (OH) 2 + C 2 H 2
3) Ca(OH) 2 + 2HNO 3 = Ca(NO 3) 2 + 2H 2 O
n (HCl) \u003d m (HCl) / M (HCl) \u003d Vp-ra (HCl) * (HCl) * p (HCl) / M (HCl) = 100 * 0,05 * 1,02 / 36,5 \u003d 0,14 mol ,
n (CaC 2) \u003d m / M \u003d 6,4 / 64 \u003d 0,1 mol.
Pagal (1) lygtį n (CaC 2) : n (HCl) = 1: 2 => CaC 2 - perteklius.
Sureagavo n (CaC 2) = n (HCl) / 2 = 0,07 mol.
Lieka n (CaC 2) \u003d 0,1 - 0,07 \u003d 0,03 mol.
Pagal (2) lygtį n (CaC 2) \u003d n (Ca (OH) 2) \u003d 0,03 mol.
Pagal (3) lygtį n(Ca(OH)2) : n(HNO3) = 1:2 =>
n (HNO 3) \u003d 2n (Ca (OH) 2) \u003d 0,06 mol.
Vr-ra (HNO 3) \u003d m (r-ra) / ρ
m (tirpalas) \u003d m (HNO 3) / ω \u003d 0,06 * 63 / 0,15 \u003d 25,2 g,
V (p-raHNO 3) \u003d 25,2 / 1,08 \u003d 23,3 ml.
Atsakymas: 23,3 ml - Natrio nitritas, sveriantis 13,8 g, buvo įpiltas kaitinant į 220 g amonio chlorido tirpalo, kurio masės dalis yra 10%. Koks tūris (N.O.) azoto išsiskirs tokiu atveju ir kokia yra amonio chlorido masės dalis gautame tirpale?
Rodyti NaNO 2 + NH 4 Cl \u003d N 2 + NaCl + 2H 2 O
n (NaNO 2) \u003d 13,8 / 69 \u003d 0,2 mol
n (NH 4 Cl) \u003d 220 0,1 / 53,5 \u003d 0,41 mol
NH 4 Cl - perteklius n (N 2) \u003d n (NaNO 2) \u003d 0,2 mol
V (N 2) \u003d 0,2 mol 22,4 l / mol \u003d 4,48 l
Apskaičiuokite likusio amonio chlorido masę:
n(NH 4 Cl) g = 0,41 - 0,2 = 0,21 mol
m (NH 4 Cl) g = 0,21 53,5 = 11,2 g Apskaičiuokite amonio chlorido masės dalį:
m(p-pa) \u003d 13,8 + 220 - 0,2 28 \u003d 228,2 g
ω (NH 4 Cl) \u003d 11,2 / 228,2 \u003d 0,049 arba 4,9 % Atsakymas:
V (N 2) \u003d 4,48 l
ω(NH 4 Cl) \u003d 4,9 % - Kalio nitritas, sveriantis 8,5 g, buvo įpiltas kaitinant į 270 g amonio bromido tirpalo, kurio masės dalis yra 12%. Koks tūris (N.O.) azoto išsiskirs šiuo atveju ir kokia yra amonio bromido masės dalis gautame tirpale?
Rodyti KNO 2 + NH 4 Br \u003d N 2 + KBr + 2H 2 O
m (in-va NH 4 Br) \u003d 270 g * 0,12 \u003d 32,4 g
n (NH 4 Br) \u003d m / M \u003d 32,4 g: 98 g / mol \u003d 0,33 mol
n(KNO 2) \u003d m / M \u003d 8,5 g: 85 g / mol \u003d 0,1 mol
n(NH4), proreakt. su KNO 2 \u003d 0,33 mol - 0,1 mol \u003d 0,23 mol (nes n (KNO 2) : n (NH 4 Br) \u003d 1: 1)
m (NH 4 Br), likęs galutiniame tirpale \u003d n * M \u003d 0,23 mol * 98 g / mol \u003d 22,54 g
n (N 2) \u003d n (KNO 2) \u003d 0,1 mol
(N 2) \u003d n * M \u003d 0,1 mol * 28 g / mol \u003d 2,8 g
V (N 2) \u003d n * M \u003d 0,1 mol * 22,4 l / mol \u003d 2,24 l
m (galutinis tirpalas) \u003d m (KNO 2) + m (NH 4 Br tirpalas) - m (N 2) \u003d 8,5 g + 270 g - 2,8 g \u003d 275,7 g
W (NH 4 Br galutiniame tirpale) = 22,54 g: 275,7 g = 8 %
Atsakymas: V (N 2) \u003d 2,24 l; W(NH 4 Br) = 8 % - Sumaišoma 300 ml sieros rūgšties tirpalo, kurio masės dalis yra 10% (tankis 1,05 g/ml) ir 200 ml kalio hidroksido tirpalo, kurio masės dalis yra 20% (tankis 1,10 g/ml). Kiek mililitrų vandens reikia įpilti į gautą mišinį, kad druskos masės dalis jame būtų 7%?
- 120 ml azoto rūgšties tirpalo, kurio masės dalis yra 7% (tankis 1,03 g/ml), buvo gauta 12,8 g kalcio karbido. Kiek mililitrų 20% druskos rūgšties (tankis 1,10 g/ml) reikia įpilti į gautą mišinį, kad jis visiškai neutralizuotų?
Rodyti 1) CaC 2 + 2HNO 3 \u003d Ca (NO 3) 2 + C 2 H 2.
n (CaC 2) \u003d 12,8 / 64 \u003d 0,2 mol
n (HNO 3) \u003d (0,07 1,03 120) / 63 \u003d 0,137 mol
CaC 2 - perteklius. 2) CaC 2 + 2H 2 O \u003d Ca (OH) 2 + C 2 H 2.
n (Ca (OH) 2) \u003d 0,2 - 0,137 / 2 \u003d 0,13 mol 3) Ca (OH) 2 + 2HCl \u003d CaCl 2 + 2H 2 O.
n(HCl) \u003d 0,13 2 \u003d 0,26 mol
m (tirpalas) \u003d m (HCl) / w \u003d (0,26 36,5) / 0,2 \u003d 47,45 g
V (HCl tirpalas) \u003d m (tirpalas) / ρ \u003d 47,45 / 1,10 \u003d 43,1 ml.
Atsakymas: 43,1 ml. - Į tirpalą, gautą į 100 ml vandens įpylus 4 g kalio hidrido, įpilama 100 ml 39 % azoto rūgšties tirpalo (r = 1,24 g/ml). Nustatykite visų medžiagų (įskaitant vandenį) masės dalis galutiniame tirpale.
Rodyti KH + H 2 O \u003d KOH + H 2
n(KH) = 4 g: 40 g/mol = 0,1 mol
n(H2O) \u003d 100 g: 18 g / mol \u003d 5,6 mol
KH trūksta, tada n (KOH) \u003d n (KH) \u003d 0,1 molKOH + H 2 NO 3 \u003d KNO 3 + H 2 O
a) m(KOH) = 0,1 * 56 = 5,6
b) m in-va (HNO 2) \u003d 100 ml * 1,24 g / ml * 0,39 \u003d 48,36 g
n (HNO 3) \u003d 48,36 g: 63 g / mol \u003d 0,77 mol
HNO 3 perteklius, n perteklius (HNO 3) \u003d 0,77 - 0,1 \u003d 0,67 mol
m (HNO 3) \u003d 0,67 * 63 \u003d 42,21 g
m (tirpalas) \u003d 4g + 100g + 124g - 0,2g \u003d 227,8g
3) W (KNO 3) \u003d m (KNO 3) : m (p-pa) \u003d (0,1 mol * 101 g / mol) 227,8 g * 100% \u003d 4,4%
W (HNO 3) \u003d 42,21: 227,8 * 100 % \u003d 18,5
W (H 2 O) \u003d 100 % - (W (KNO 3) + W (HNO 3)) \u003d 77,1 %
Atsakymas:
W(KNO 3) = 4,4 %
W(HNO 3) \u003d 18,5 %
W(H2O) = 77,1 %1) 2Na 2 O 2 + 2H 2 O \u003d 4NaOH + O 2
2) 2NaOH + H2SO4 = Na2SO4 + 2H2O
m (H 2 SO 4 tirpalas) \u003d 300 * 1,08 \u003d 324 g
m (H 2 SO 4) \u003d 0,1 * 324 \u003d 32,4 g
n (H 2 SO 4) \u003d 32,4 / 98 \u003d 0,33 mol
n(NaOH): n(H2SO4) = 2:1 => n(NaOH) = 0,33 * 2 = 0,66 mol
n(Na 2 O 2): n(NaOH) = 1:2 => n(Na2O2) = 0,66/2 = 0,33 mol
m (Na 2 O 2) \u003d n * M = 0,33 * 78 \u003d 25,7 g
n(Na2O2): n(O2) = 2:1 => n(O2) = 0,33/2 = 0,165 mol
V (O 2) \u003d 0,165 * 22,4 \u003d 3,7 l
Atsakymas: m (Na 2 O 2) \u003d 25,7 g; V (O 2) \u003d 3,7 l - Kaitinamas kalio bikarbonatas virsta karbonatu. Apskaičiuokite kalio bikarbonato masės dalį pradiniame tirpale, kurį kaitinant galite gauti 8% kalio karbonato tirpalą.
- Sąveikaujant sieros rūgšties terpėje, išsiskyrė 17,4 g mangano dioksido su 58 g kalio bromido, bromo išeiga 77%. Koks tūris (N.O.) propeno gali reaguoti su gautu bromo kiekiu?
- 5,6 l (n.o.) tūrio anglies dioksidas buvo praleistas per 164 ml 20 % natrio hidroksido tirpalo (ρ = 1,22 g/ml). Nustatykite medžiagų sudėtį ir masės dalis gautame tirpale.
- Aliuminio karbidas buvo ištirpintas 15% sieros rūgšties tirpale, sveriančiame 300 g. Tuo pačiu metu išsiskyręs metanas užėmė 2,24 l (n.o.) tūrį. Apskaičiuokite sieros rūgšties masės dalį gautame tirpale.
- Esant deguonies pertekliui, sudegė 8 g sieros. Gautos dujos praleidžiamos per 200 g 8% natrio hidroksido tirpalo. Gautame tirpale nustatykite druskų masės dalis.
- Aliuminio ir geležies drožlių mišinys buvo apdorotas praskiestos druskos rūgšties pertekliumi ir išsiskyrė 8,96 l (n.o.) vandenilio. Jei ta pati masė mišinio apdorojama natrio hidroksido tirpalo pertekliumi, išsiskirs 6,72 litro (N.O.) vandenilio. Apskaičiuokite geležies masės dalį pradiniame mišinyje.
- Magnio ir cinko drožlių mišinys buvo apdorotas praskiestos sieros rūgšties pertekliumi ir išsiskyrė 22,4 litro (n.o.) vandenilio. Jei ta pati masė mišinio apdorojama natrio šarmo tirpalo pertekliumi, tuomet išsiskirs 13,44 l (n.o.) vandenilio. Apskaičiuokite magnio masės dalį pradiniame mišinyje.
2KHCO 3 + H 2 SO 4 = K 2 SO 4 + 2CO 2 + 2H 2 O (2) Na 2 CO 3 + 2HCl \u003d NaCl + CO 2 + H 2 O
NaHCO 3 + HCl \u003d NaCl + CO 2 + H 2 O
NaHCO 3 + NaOH \u003d Na 2 CO 3 + H 2 O
1) rastisumaNaHCO3
n(NaOH)=(NaHCO3)=m(NaOH) . ω (NaOH) / M (NaOH) \u003d 80 * 0,1 / 40 \u003d 0,2 mol
2) rastimasėNaHCO3
m(NaHCO3)=n(NaHCO3)*M(NaHCO3)=0,2. 84=16,8 g
3) Raskite Na 2 CO 3 kiekį
n(HCl) = m(HCl) . ω (HCl) / M (HCl) \u003d 73 * 0,2 / 36,5 \u003d 0,4 mol
n (Na 2 CO 3) \u003d (n (HCl) - n (NaOH)) / 2 \u003d 0,1 mol
4) rasti masęNa 2 CO 3
m(Na2CO3)=n. M = 0,1. 106 = 10,6 g
5) raskite masės dalįNa2CO3
ω (Na 2 CO 3) \u003d m (Na 2 CO 3) / m (mišinys) . 100 % = 38,7 %
m(mišinys).=m(Na2CO3)+m(NaHCO3)=27,4 g
Atsakymas: ω (Na 2 CO 3) \u003d 38,7 %1) 2Na + 2H2O → 2NaOH + H2
2) Na 2 O + H 2 O → 2NaOH
1) rasti kiekįNa
n(H 2) \u003d V / Vm \u003d 4,48 / 22,4 \u003d 0,2 mol
Pagal (1) lygtį n (Na) \u003d n 1 (NaOH) \u003d 2. n(H2) = 0,4 mol
2) raskite masęNa
m(Na) = n . M = 0,4. 23 = 9,2 g
3) rasti kiekįNaOH
n(NaOH) = m(p-p) . ω/M(NaOH) = 240 um. 0,1/40 = 0,6 mol
4) rasti kiekįNa 2 O
n (Na 2 O) \u003d (n (NaOH) - n 1 (NaOH)) / 2 \u003d 0,1 mol
m(Na2O)= n. M = 0,1. 62 = 6,2 g
5) rastimmasinė dalisNa
ω (Na) = m(Na)/m(mišiniai) . 100 % = 59,7 %
m(mišinys)=m(Na)+m(Na2O)=15,4
Atsakymas: ω (Na)=59,7%
1) Raskite bendrą sumąH2SO4
n 1 (H 2 SO 4) \u003d m. ω/M=490 . 0,4/98=2 mol
M (H 2 SO 4) \u003d 2 + 32 + 64 \u003d 98 g / mol
2) RaskimeH2SO4sureagavoSuNa2CO3
n (Na 2 CO 3) \u003d n (Na 2 CO 3. 10H 2 O) \u003d m / M \u003d 143/286 \u003d 0,5 mol
M (Na 2 CO 3. 10H 2 O) \u003d (46 + 12 + 48) + (10, 18) \u003d 286 g / mol
Pagal lygtį n (H 2 SO 4) \u003d n (Na 2 CO 3) \u003d 0,5 mol
3) rastiH 2 TAIP 4 sureagavo suNaOH
n (H 2 SO 4) \u003d n 1 -n \u003d 2-0,5 \u003d 1,5 mol
4) Raskite NaOH masę
n(NaOH)=2n(H2SO4)=2. 1,5=3 mol
m(NaOH)=n. M = 3. 40=120 g
M(NaOH)=23+16+1=18 g/mol
5) raskite masės dalįNaOH
ω (NaOH) \u003d m (medžiaga) / . m(p-p)*100%=120/1200 . 100 % = 10 %
Atsakymas: m(NaOH)=120g; ω(NaOH)=10 %
48) Magnio ir aliuminio drožlių mišinys buvo apdorotas praskiestos druskos rūgšties pertekliumi ir išsiskyrė 11,2 litro (n.o.) vandenilio. Jei tokia pati mišinio masė apdorojama kalio hidroksido tirpalo pertekliumi, išsiskirs 6,72 litro (N.O.) vandenilio. Apskaičiuokite magnio masės dalį pradiniame mišinyje.
49) Kalcio karbidas, sveriantis 6,4 g, buvo ištirpintas 87 ml vandenilio bromido rūgšties (ρ = 1,12 g / ml), kurios masės dalis yra 20%. Kokia yra vandenilio bromido masės dalis gautame tirpale?
Užduočių rūšys Mišinio užduotys Užduoties sąlygoje yra žodžiai: „mišinys“, „techninė“, „priemaiša“, mineralų ar lydinių pavadinimai Tirpalų užduotys Užduoties sąlygoje yra žodžiai: „tirpalas“, „tirpalo masės dalis“. ištirpusi medžiaga“ Užduotys dėl pertekliaus Trūkumas Užduoties sąlygoje pateikiama informacija apie abu reagentus Produkto išeiga Užduotys Užduoties sąlygoje yra žodžiai: „medžiagos išeiga“, „produkto išeigos masės dalis“ Užduotys, kuriose naudojami vienos reakcijos produktai. atlikti kitą reakciją.


Štai iššūkis... Norint sureaguoti 6,3 gramo aliuminio ir magnio mišinio su sieros rūgštimi, reikia 275,8 ml 10 % sieros rūgšties tirpalo (tankis 1,066 g/ml). Nustatykite, kokios masės 20% bario chlorido tirpalo reikės, kad iš gauto tirpalo visiškai nusodintų metalo sulfatai.


Nustatykime sieros rūgšties kiekį tirpale: m (p-ra) \u003d V (p-ra). = 278,8. 1,066 \u003d 294 (g) m (H 2 SO 4) \u003d m (tirpalas). w (H 2 SO 4) \u003d, 1 \u003d 29,4 g n (H 2 SO 4) \u003d 29,4 / 98 \u003d 0,3 mol Dar 1 taškas!


Nustatykime tirpalo masę: n (BaCl2) = 0,3 mol m (BaCl2) = ,3 = 62,4 (g) m (p-ra BaCl2) = 62,4: 0,2 = 312 (g) Atsakymas: m (p-ra) BaCl 2) \u003d 312 g Ir dar 1 taškas Iš viso - 4 taškai Iš viso - 4 taškai






Uždavinio sprendimo ir rezultatų vertinimo elementai 1. Teisingai parašytos visų reakcijų lygtys. 2. Surastas pradinių medžiagų „medžiagos kiekis“ (tūris, masė) 3. Sudaryta lygčių sistema medžiagų kiekiui mišinyje rasti. 4. Suskaičiuoti galutiniai užduotyje užduodami duomenys. Visi elementai atlikti teisingai - 4 taškai Padaryta viena klaida - 3 taškai Padarytos dvi klaidos - 2 taškai Padarytos trys klaidos - 1 balas Visi elementai atlikti neteisingai - 0 taškų

Savarankiško sprendimo uždaviniai Cinko ir cinko karbonato mišinys buvo apdorotas druskos rūgšties tirpalo pertekliumi ir išsiskyrė 13,44 litro dujų (n.a.). Dujos buvo sudegintos, degimo produktai atšaldomi iki buvusios temperatūros, o dujų tūris sumažėjo iki 8,96 litro. Kokia buvo pradinio medžiagų mišinio sudėtis?


Namų darbas 1 Natrio nitritas, sveriantis 13,8 g, buvo pridėtas kaitinant į 220 g amonio chlorido tirpalo, kurio masės dalis yra 10%. Koks tūris (N.O.) azoto išsiskirs tokiu atveju ir kokia yra amonio chlorido masės dalis gautame tirpale? Atsakymas: w (NH 4 Cl) \u003d 4,9 %

2 namų darbas Kalio nitritas, sveriantis 8,5 g, buvo pridėtas kaitinant į 270 g amonio bromido tirpalo, kurio masės dalis yra 12%. Koks tūris (N.O.) azoto išsiskirs šiuo atveju ir kokia yra amonio bromido masės dalis gautame tirpale? Atsakymas: V (N 2) \u003d 2,24 l, w (NH 4 Br) \u003d 8,2 %

3 namų darbas Sumaišome 300 ml sieros rūgšties tirpalo, kurio masės dalis yra 10% (tankis 1,05 g/ml) ir 200 ml kalio hidroksido tirpalo, kurio masės dalis yra 20% (tankis 1,10 g/ml). . Kokį tūrį vandens reikia įpilti į gautą mišinį, kad druskos masės dalis jame būtų 7%? Atsakymas: V = 262,9 litro

4 namų darbas Į 120 ml azoto rūgšties tirpalo, kurio masės dalis yra 7% (tankis 1,03 g / ml), buvo pridėta 12,8 g kalcio karbido. Kokį tūrį 20% druskos rūgšties (tankis 1,10 g/ml) reikia įpilti į gautą mišinį, kad jis visiškai neutralizuotų? Atsakymas: V = 43,1 ml

5 namų darbas Sąveikaujant sieros rūgšties terpėje išsiskyrė 8,7 g mangano dioksido su 22,4 g kalio bromido, bromo, kurio praktinė išeiga buvo 88 proc. Koks tūris (n.c.) etileno gali reaguoti su gautu bromo kiekiu? Atsakymas: V = 1,86 L


- Nustatykite Mg 3 N 2, visiškai suskaidyto vandeniu, masę, jei druskai susidaryti su hidrolizės produktais reikėjo 150 ml 4% druskos rūgšties tirpalo, kurio tankis yra 1,02 g / ml.
Rodyti 1) Mg3N2 + 6H2O → 3Mg (OH)2 + 2NH3
2) Mg(OH) 2 + 2HCl → MgCl 2 + 2H 2 O
3) NH 3 + HCl → NH 4 Cl
n (HCl) \u003d 150 * 1,02 * 0,04 / 36,5 \u003d 0,168 mol
Leiskite x mol Mg 3 N 2 reaguoti. Pagal 1 lygtį susidarė 3x mol Mg(OH) 2 ir 2x mol NH 3. Norint neutralizuoti 3x mol Mg(OH) 2, reikėjo 6x mol HCl (pagal 2 lygtį), o neutralizuojant 2x mol NH 3 - 2x mol HCl (pagal 3 lygtį), iš viso 8x mol HCl. .
8 x \u003d 0,168 mol,
X \u003d 0,021 mol,
n (Mg 3 N 2) \u003d 0,021 mol,
m (Mg 3 N 2) \u003d M * n = 100 * 0,021 \u003d 2,1 g.
Atsakymas: 2,1 g - Nustatoma natrio karbonato masės dalis tirpale, gautame virinant 150 g 8,4 % natrio bikarbonato tirpalo. Koks tūris 15,6% bario chlorido tirpalo (tankis 1,11 g / ml) sureaguos su gautu natrio karbonatu? Galima nepaisyti vandens išgaravimo.
Rodyti 1) 2NaHCO 3 - t → Na 2 CO 3 + H 2 O + CO 2
2) Na 2 CO 3 + BaCl 2 → BaCO 3 + 2 NaCl
n (NaHCO 3) \u003d 150 * 0,084 / 84 \u003d 0,15 mol
Iš (1) lygties n (NaHCO 3) : n (Na 2 CO 3) = 2:1 => n (Na 2 CO 3) = 0,075 mol.
m (Na 2 CO 3) \u003d 0,075 ∙ 106 \u003d 7,95 g
n (CO 2) \u003d 0,075 mol, m (CO 2) \u003d 0,075 ∙ 44 \u003d 3,3 g
m (tirpalas) \u003d 150 - 3,3 \u003d 146,7 g
ω (Na 2 CO 3) \u003d m (Na 2 CO 3) / m (tirpalas) \u003d 7,95 / 146,7 \u003d 0,0542 arba 5,42 %
Iš (2) lygties n (Na 2 CO 3) : n (BaCl 2) = 1: 1 => n (BaCl 2) = 0,075 mol.
m (BaCl 2) \u003d n * M = 0,075 * 208 \u003d 15,6 g.
m (tirpalas) \u003d m (BaCl 2) / ω \u003d 15,6 / 0,156 \u003d 100 g
V (tirpalas) \u003d m (tirpalas) / ρ \u003d 100 / 1,11 \u003d 90,1 ml.
Atsakymas: 5,42%, 90,1 ml. - Kokiais masių santykiais reikia sumaišyti 10 % natrio hidroksido ir sieros rūgšties tirpalus, kad gautųsi neutralus natrio sulfato tirpalas? Kokia yra druskos masės dalis šiame tirpale?
Rodyti 2NaOH + H2SO4 → Na2SO4 + 2H2O
Tegul NaOH tirpalo masė yra 100 g, m(NaOH)= 10 g,
n(NaOH) = 0,25 mol,
n(H2SO4) = 0,125 mol,
m (H 2 SO 4) \u003d 12,25 g,
m (H 2 SO 4 tirpalas) = 122,5 g
Santykis m (NaOH tirpalas) : m (H 2 SO 4 tirpalas) = 1:1,2
n(Na2SO4) = 0,125 mol,
m (Na 2 SO 4) \u003d 17,75 g,
m (tirpalas) \u003d 100 + 122,5 g \u003d 222,5 g,
w(Na 2 SO 4) = 7,98 % - Kiek litrų chloro (N.O.) išsiskirs, jei kaitinant į 200 ml 35% druskos rūgšties (tankis 1,17 g/ml) įpilama 26,1 g mangano (IV) oksido? Kiek gramų natrio hidroksido šaltame tirpale sureaguos su tokiu chloro kiekiu?
Rodyti 1) MnO 2 + 4 HCl → MnCl 2 + 2 H 2 O + Cl 2
2) 2NaOH + Cl 2 → NaCl + NaClO + H 2 O
n (HCl) \u003d 200 * 1,17 * 0,35 / 36,5 \u003d 2,24 mol - perteklius
n (MnO 2) \u003d 26,1 / 87 \u003d 0,3 mol - trūksta
Pagal (1) lygtį n (Cl 2) \u003d 0,3 mol
V (Cl 2) \u003d 6,72 l
Pagal (2) lygtį n(NaOH)= 0,6 mol, m(NaOH)=24 g
Atsakymas: 6,72 l, 24 g - Kokiame vandens tūryje reikia ištirpinti 11,2 litro sieros oksido (IV) (n.a.), kad gautųsi sieros rūgšties tirpalas, kurio masės dalis yra 1 %? Kokią spalvą įgaus lakmusas, įpylus jo į gautą tirpalą?
- Kokią masę ličio hidrido reikia ištirpinti 100 ml vandens, kad būtų gautas tirpalas, kurio hidroksido masės dalis yra 5%? Kokią spalvą įgaus lakmusas, įpylus jo į gautą tirpalą?
Rodyti LiH + H2O → LiOH + H2
Tegul m (LiH) = x g, tada m (LiOH) = x * 24/8 = 3 x g.
m (tirpalas) \u003d m (H 2 O) + m (LiH) - m (H 2)
m (r-ra) \u003d x + 100 - x / 4 \u003d 0,75x + 100
w \u003d m (in-va) * 100 % / m (r-ra)
3x/(0,75x+100) = 0,05
3x=0,038x+5
2,96x = 5
x = 1,7 g - Kokioje masėje tirpalo, kurio Na 2 SO 4 masės dalis yra 10 %, reikia ištirpinti 200 g Na 2 SO 4 × 10H 2 O, kad būtų gautas tirpalas, kurio natrio sulfato masės dalis yra 16 %? Kokią terpę turės gautas tirpalas?
Rodyti Tegul tirpalo masė x g. Jame yra 0,1 x g Na 2 SO 4.
Įpilta 200 g kristalinio hidrato, kuriame natrio sulfato masė 200*142/322=88,2 g.
(0,1 x +88,2) / (x + 200) \u003d 0,16
0,1x +88,2 = 0,16x + 32
0,06x = 56,2
x = 937
Atsakymas: 937 g, neutralus. - Dujinis amoniakas, išsiskyręs verdant 160 g 7% kalio hidroksido tirpalo su 9,0 g amonio chlorido, buvo ištirpintas 75 g vandens. Nustatykite amoniako masės dalį gautame tirpale.
- Amoniakas, išsiskyręs verdant 80 g 14 % kalio hidroksido tirpalo su 8,03 g amonio chlorido, ištirpo vandenyje. Apskaičiuokite, kiek mililitrų 5% azoto rūgšties, kurios tankis 1,02 g / ml, bus sunaudota gautam amoniako tirpalui neutralizuoti.
Rodyti KOH + NH 4 Cl → NH 3 + H 2 O + KCl
NH 3 + HNO 3 → NH 4 NO 3
n (NH 4 Cl) \u003d 8,03 / 53,5 \u003d 0,15 mol
m (KOH) \u003d 80 * 0,14 \u003d 11,2 g
n (KOH) \u003d 11,2 / 56 \u003d 0,2 mol
KOH yra perteklius.
Tolesni skaičiavimai atliekami pagal trūkumą
n (NH 4 Cl) \u003d n (NH 3) \u003d 0,15 mol
n (HNO 3) \u003d 0,15 mol
m (HNO 3) \u003d n * M = 0,15 * 63 \u003d 9,45 g
m (p-ra HNO 3) \u003d m (in-va) * 100% / w \u003d 9,45 / 0,05 \u003d 189 g
m = V*ρ
V = m / ρ = 189 / 1,02 = 185,3 ml
Atsakymas: 185,3 ml - Kalcio karbidas, apdorotas vandens pertekliumi. Išsiskyrusios dujos užėmė 4,48 litro tūrį (N.O.). Apskaičiuokite, koks tūris 20% druskos rūgšties, kurios tankis yra 1,10 g / ml, bus naudojamas visiškai neutralizuoti iš kalcio karbido susidariusį šarmą.
Rodyti 1) CaC 2 + 2H 2 O \u003d Ca (OH) 2 + C 2 H 2
n (C 2 H 2) \u003d V / V m \u003d 4,48 / 22,4 \u003d 0,2 mol
Iš (1) lygties => n(C 2 H 2) = n(Ca(OH) 2)
n (Ca (OH) 2) \u003d 0,2 mol
2) Ca (OH) 2 + 2HCl \u003d CaCl 2 + 2H 2 O
Iš (2) lygties => n(Ca(OH) 2) : n(HCl) = 1:2 => n(HCl) = 0,4 mol
m(HCl) \u003d n * M = 0,4 * 36,5 \u003d 14,6 g
m (HCl tirpalas) \u003d 14,6 / 0,2 \u003d 73 g
V (HCl tirpalas) = 73/1,1 = 66,4 ml - Apskaičiuokite, koks tūris 10% vandenilio chlorido tirpalo, kurio tankis 1,05 g/ml, bus naudojamas visiškai neutralizuoti kalcio karbido hidrolizės metu susidariusį kalcio hidroksidą, jei hidrolizės metu išsiskiriančios dujos užima 8,96 l (n.o.) tūrį. .
Rodyti CaC 2 + 2 H 2 O → Ca (OH) 2 + C 2 H 2
Ca(OH) 2 + 2 HCl → CaCl 2 + 2 H 2 O
n(C 2 H 2) = V / V n.o.s. = 8,96 / 22,4 = 0,4 mol
n (C 2 H 2) \u003d n Ca (OH) 2 \u003d 0,4 mol
n(HCl) = 0,4 * 2 = 0,8 mol
m (HCl) \u003d n * M = 0,8 * 36,5 \u003d 29,2 g
w \u003d m (in-va) * 100 % / m (r-ra)
m (tirpalas) \u003d m (in-va) * 100% / w \u003d 29,2 / 0,1 \u003d 292 g
m = V*ρ
V= m / ρ = 292 / 1,05 = 278 ml
Atsakymas: 278 ml - Aliuminio karbidas, apdorotas 200 g 30% sieros rūgšties tirpalo. Tuo pačiu metu išsiskyręs metanas užėmė 4,48 l (n.o.) tūrį. Apskaičiuokite sieros rūgšties masės dalį gautame tirpale.
Rodyti Al 4 C 3 + 6H 2 SO 4 → 2Al 2 (SO 4) 3 + 3CH 4
n(CH 4) \u003d V / Vm \u003d 4,48 / 22,4 \u003d 0,2 mol
m (CH 4) \u003d m * M = 0,2 * 16 \u003d 3,2 g
m (Al 4 C 3) \u003d 1/3 * 0,2 * 144 \u003d 9,6 g
Reagavo pagal lygtį n (H 2 SO 4) \u003d 0,4 mol,
m (H 2 SO 4) \u003d 0,4 * 98 \u003d 39,2 g.
Iš pradžių buvo pridėta m (H 2 SO 4) = m (p-ra) * ω = 200 g * 0,3 = 60 g. Liko m (H 2 SO 4) = 60 - 39,2 = 20,8 g.
m (H 2 SO 4) \u003d 0,21 * 98 \u003d 20,8 g
m (p-pa) \u003d m (Al 4 C 3) + m (p-pa H 2 SO 4) - m (CH 4)
m(p-pa) = 9,6 g + 200 g - 3,2 g = 206,4 g
ω (H 2 SO 4) \u003d m (H 2 SO 4) / m (tirpalas) \u003d 20,8 / 206,4 * 100 % \u003d 10 % - Aliuminio karbidą apdorojant druskos rūgšties tirpalu, kurio masė 320 g, o HCl masės dalis 22%, išsiskyrė 6,72 l (n.o.) metano. Apskaičiuokite druskos rūgšties masės dalį gautame tirpale.
Rodyti Al 4 C 3 + 12HCl → 4AlCl 3 + 3CH 4 n (CH 4) \u003d V / Vm \u003d b,72 / 22,4 \u003d 0,3 mol;
Pagal lygtį n (HCl) \u003d 4 n (CH 4) \u003d 1,2 mol
m (HCl) \u003d m (tirpalas) * ω \u003d 320 0,22 \u003d 70,4 g;
Sureagavo m (HCl) \u003d 1,2 36,5 \u003d 43,8 g.
Likęs m(HCl) = 70,4 - 43,8 = 26,6 g.
m (p-pa) \u003d 320 g + m (Al 4 C 3) - m (CH 4),
Pagal lygtį n (Al 4 C 3) \u003d 1/3 n (CH 4) \u003d 0,1 mol;
m (Al 4 C 3) \u003d 0,1 144 \u003d 14,4 g,
m(CH 4) \u003d 0,3 16 \u003d 4,8 g,
m(p-pa) \u003d 320 g + 14,4 g - 4,8 g \u003d 329,6 g.
ω(HCl) = 26,6 / 329,6 100 % = 8,07 % - Kalcio hidrido buvo pridėta prie druskos rūgšties tirpalo pertekliaus (rūgšties tirpalo masė 150 g, HCl masės dalis 20%). Šiuo atveju buvo išleista 6,72 l (N.O.) vandenilio. Apskaičiuokite kalcio chlorido masės dalį gautame tirpale.
Rodyti n (CaCl 2) \u003d ½ n (H 2) \u003d 0,15 mol
m (CaCl 2) \u003d 111 * 0,15 \u003d 16,65 g
W (CaCl 2) \u003d m in-va / m tirpalas \u003d 16,65 / 155,7 \u003d 0,1069 arba 10,69%
Atsakymas: W (CaCl 2) \u003d 10,69 % - Sumaišyta 125 ml 5 % ličio hidroksido tirpalo (r = 1,05 g/ml) ir 100 ml 5 % azoto rūgšties tirpalo (ρ = 1,03 g/ml). Nustatykite gauto tirpalo terpę ir ličio nitrato masės dalį joje.
Rodyti LiOH + HNO₃ = LiNO₃ + H2O
m (LiOH tirpalas) = V × ρ = 125 ml × 1,05 g/ml = 131,25 g
m(LiOH) = 131,25 g × 0,05 = 6,563 g
n(LiOH) \u003d m / M \u003d 6,563 / 24 \u003d 0,273 mol
m (HNO₃ tirpalas:) = V × ρ = 100 ml × 1,03 g/ml = 103 g
m(HNO3) = 103 g × 0,05 = 5,15 g
n(HNO3) = 5,15 / 63 = 0,0817 mol
LiOH pateiktas perteklius, skaičiuojama remiantis rūgštimi.
n(LiNO3) = 0,0817 mol
m (LiNO₃) = n × M = 0,0817 × 69 = 5,64 g
m (gautas tirpalas) \u003d m (LiOH tirpalas) + m (HNO₃ tirpalas) \u003d 131,25 g + 103 g \u003d 234,25 g
ω(LiNO₃) = 5,64 / 234,25 × 100 % = 2,4 %
Atsakymas: šarminis, 2,4%; - Fosforo (V) oksidas, sveriantis 1,42 g, ištirpintas 60 g 8,2 % ortofosforo rūgšties ir gautas tirpalas virinamas. Kokia druska ir koks kiekis susidaro, jei į gautą tirpalą įpilama 3,92 g kalio hidroksido?
- Sieros oksidas (VI), sveriantis 8 g, buvo ištirpintas 110 g 8% sieros rūgšties. Kokia druska ir koks kiekis susidaro, jei į gautą tirpalą įpilama 10,6 g kalio hidroksido?
Rodyti SO 3 + H 2 O \u003d H 2 SO 4
n \u003d m / MM (SO 3) \u003d 80 g / mol,
n(SO 3) \u003d 8/80 \u003d 0,1 mol.
Pagal (1) lygtį n (H 2 SO 4) \u003d n (SO 3) \u003d 0,1 mol,
n(KOH)=10,6/56=0,19 mol.
Pradiniame tirpale n (H 2 SO 4) \u003d 110 * 0,08 / 98 \u003d 0,09 mol.
Pridėjus sieros oksido n (H 2 SO 4) \u003d 0,09 + 0,1 \u003d 0,19 mol.
Šarmų ir rūgšties santykis yra 1:1, vadinasi, susidaro rūgšties druska.
H 2 SO 4 + KOH \u003d KHSO 4 + H 2 O
n (H 2 SO 4) \u003d n (KOH) \u003d n (KHSO 4) \u003d 0,19 mol
Atsakymas: KHSO 4, 0,19 mol. - Amoniakas, išsiskyręs sąveikaujant 107 g 20 % amonio chlorido tirpalo su 150 g 18 % natrio hidroksido tirpalu, visiškai sureagavo su 60 % fosforo rūgštimi ir susidarė amonio-divandenilio fosfatas. Nustatoma natrio chlorido masės dalis tirpale ir reikiama 60 % fosforo rūgšties tirpalo masė.
Rodyti NH 4 Cl + NaOH = NaCl + NH 3 + H 2 O
m(NH 4 Cl) \u003d 107 g ∙ 0,2 \u003d 21,4 g
n (NH 4 Cl) \u003d 21,4 g / 53,5 g / mol \u003d 0,4 mol
m(NaOH) = 150 g ∙ 0,18 = 27 g
n(NaOH) = 27 g / 40 g / mol = 0,675 mol, todėl NaOH yra perteklius
n(NaCl) = n(NH4Cl) = 0,4 mol
m(NaCl) = 0,4 ∙ 58,5 = 23,4 g
n (NH 3) \u003d n (NH 4 Cl) \u003d 0,4 mol
m (NH 3) \u003d 0,4 ∙ 17 \u003d 6,8 g
m (tirpalas) \u003d m (tirpalas NH 4 Cl) + m (tirpalas NaOH) - m (NH 3) \u003d 107 + 150 - 6,8 \u003d 250,2 g
w(NaCl) = 23,4 / 250,2 = 0,094 arba 9,4 %
NH 3 + H 3 PO 4 \u003d NH 4 H 2 PO 4
n (NH 3) \u003d n (H 3 PO 4) \u003d 0,4 mol
m (H 3 PO 4) \u003d 98 ∙ 0,4 \u003d 39,2 g
m (H 3 PO 4 tirpalas) \u003d 39,2 / 0,6 \u003d 65,3 g - Vandenilio sulfidas, išsiskyręs sąveikaujant koncentruotos sieros rūgšties pertekliui su 1,44 g magnio, buvo praleistas per 160 g 1,5% bromo tirpalo. Nustatykite šiuo atveju susidariusių nuosėdų masę ir rūgšties masės dalį gautame tirpale.
Rodyti 4Mg + 5H2SO4 \u003d 4MgSO4 + H2S + 4H2O
H 2 S + Br 2 \u003d 2HBr + S ↓
n(Mg) \u003d m / M \u003d 1,44 g: 24 g / mol \u003d 0,06 mol
n(H2S) = ¼ n(Mg) = 0,015 mol
m (H 2 S) \u003d n * M = 0,015 mol * 34 g / mol \u003d 0,51 mol
m (in-va Br 2) \u003d 160 g * 0,015 \u003d 2,4 g
n(Br 2) \u003d m / M \u003d 2,4 g: 160 g / mol \u003d 0,015 mol
n (HBr) \u003d 2n (Br 2) \u003d 0,03 mol
m(HBr) \u003d n * M = 0,03 mol * 81 g / mol \u003d 2,43 g
n(S) \u003d n (Br 2) \u003d 0,015 mol
m(S) = n * M = 0,015 mol * 32 g/mol = 0,48 g
m (tirpalas) \u003d m (H 2 S) + m (tirpalas Br 2) -m (S) \u003d 0,51 g + 160 g - 0,48 \u003d 160,03 g
W (HBr) \u003d m (HBr) / m (tirpalas) = 2,43 g / 160,03 g \u003d 0,015 arba 1,5 %
Atsakymas: m (S) \u003d 0,48 g, w (HBr) \u003d 1,5 % - Chloras be likučių reagavo su 228,58 ml 5% NaOH tirpalo (tankis 1,05 g/ml) aukštesnėje temperatūroje. Nustatykite gauto tirpalo sudėtį ir apskaičiuokite medžiagų masės dalis šiame tirpale.
Rodyti 6NaOH + 3Cl2 = 5NaCl + NaClO3 + 3H 2O (esant t)
m tirpalas \u003d 228,58 ∙ 1,05 \u003d 240 g;
m(NaOH) \u003d 240 ∙ 0,05 \u003d 12g.
n(NaOH) = 12/40 = 0,3 mol;
n(Cl2) = 0,15 mol;
n(NaCl) = 0,25 mol;
n(NaClO 3) = 0,05 mol
m (NaCl) \u003d 58,5 ∙ 0,25 \u003d 14,625 g;
m (NaClO 3) \u003d 106,5 ∙ 0,05 \u003d 5,325 g:
m tirpalas \u003d 240 + m (Cl 2) \u003d 240 + 71 ∙ 0,15 \u003d 240 + 10,65 \u003d 250,65 g
W(NaCl) = 14,625 / 250,65 = 0,0583 arba 5,83 %
W (NaClO 3) \u003d 5,325 / 250,65 \u003d 0,0212 arba 2,12 % - Varis, sveriantis 6,4 g, buvo apdorotas 100 ml 30 % azoto rūgšties (ρ = 1,153 g/ml). Kad produktai būtų visiškai surišti, į gautą tirpalą įpilama 200 g natrio hidroksido tirpalo. Nustatykite šarmo masės dalį panaudotame tirpale.
Rodyti 3Cu + 8HNO 3 \u003d 3Cu (NO 3) 2 + 2NO + 4H 2 O
m (HNO 3) \u003d 100 ∙ 0,3 ∙ 1,153 \u003d 34,59 g
n(HNO3) = 34,59/63 = 0,55 mol, n(Cu) = 6,4/64 = 0,1 mol
n (HNO 3) g = 0,55 - 8/3 ∙ 0,1 = 0,28 mol
Cu (NO 3) 2 + 2 NaOH \u003d Cu (OH) 2 + 2 NaNO 3
HNO 3 + NaOH \u003d NaNO 3 + H 2 O
n(NaOH) \u003d n (HNO 3) g + 2n (Cu (NO 3) 2) \u003d 0,28 + 0,1 ∙ 2 \u003d 0,48 mol
m (NaOH) \u003d 0,48 ∙ 40 \u003d 19,2 g.
W(NaOH) = 19,2 / 200 = 0,096 arba 9,6 % - 60 g 18 % ortofosforo rūgšties ištirpinta 2,84 g fosforo (V) oksido ir gautas tirpalas užvirinamas. Kokia druska ir koks kiekis susidaro, jei į gautą tirpalą įpilama 30 g natrio hidroksido?
Rodyti 1) 3H2O + P2O5 → 2H3PO4
Pradiniame tirpale m (H 3 PO 4) \u003d m (tirpalas) * ω \u003d 60 * 0,18 \u003d 10,8 g.
n(P2O5) = m/M = 2,84/142 = 0,02 mol
Dėl reakcijos susidarė m (H 3 PO 4) \u003d 0,04 * 98 \u003d 3,92 g
Bendras m (H 3 PO 4) \u003d 3,92 + 10,8 \u003d 14,72 g.
n (H 3 PO 4) \u003d m / M \u003d 14,72 / 98 \u003d 0,15 mol
n (NaOH) \u003d m / M \u003d 30/40 \u003d 0,75 mol - perteklius, druska yra vidutinė.
2) 3NaOH + H3PO4 → Na3PO4 + 3H2O
Pagal (2) lygtį n (Na 3 PO 4) \u003d n (H 3 PO 4) \u003d 0,15 mol
m (Na 3 PO 4) \u003d 0,15 * 164 \u003d 24,6 g
Atsakymas: 24,6 g - Per 200 g 4,9% fosforo rūgšties tirpalo buvo praleidžiamas 4,48 l (n.o.) tūrio amoniakas. Pavadinkite druskos, susidariusios reakcijos metu, pavadinimą ir nustatykite jos masę.
- 5,6 l (n.o.) vandenilio sulfido be nuosėdų sureagavo su 59,02 ml 20% KOH tirpalo (tankis 1,186 g/ml). Nustatykite šios cheminės reakcijos metu susidariusios druskos masę.
Rodyti m (p-ra KOH) \u003d V * ρ \u003d 1,186 * 59,02 \u003d 70 g,
m (KOH) \u003d m (p-raKOH) * ω \u003d 70 g * 0,2 \u003d 14 g,
n (KOH) \u003d m / M \u003d 14/56 \u003d 0,25 mol,
n (H 2 S) \u003d V / Vm \u003d 5,6 / 22,4 \u003d 0,25 mol.
Vandenilio sulfido kiekis lygus šarmo kiekiui, todėl susidaro rūgšties druska - hidrosulfidas pagal reakciją: H 2 S + KOH \u003d KHS + H 2 O
Pagal lygtį n(KHS) = 0,25 mol,
m (KHS) \u003d M * n = 72 0,25 \u003d 18 g.
Atsakymas: 18 - 7,6 g skruzdžių ir acto rūgščių mišinio neutralizuoti buvo panaudota 35 ml 20 % kalio hidroksido tirpalo (tankis 1,20 g/ml). Apskaičiuokite acto rūgšties masę ir jos masės dalį pradiniame rūgščių mišinyje.
Rodyti COOH + KOH \u003d NSOOK + H 2 O
CH 3 COOH + KOH \u003d CH 3 COOK + H 2 O
m (p-paKOH) \u003d V (p-pa) * ρ \u003d 35 * 1,2 \u003d 42 g.
m (KOH) \u003d m (p-pa) * ω (KOH) = 42 * 0,2 \u003d 8,4 g
n (KOH) \u003d m (KOH) / M (KOH) \u003d 8,4 / 56 \u003d 0,15 mol
Tegul n (HCOOH) \u003d x mol ir n (CH 3 COOH) \u003d y mol.
m (HCOOH) \u003d n (HCOOH) * M (HCOOH) \u003d x * 46 g
m (CH 3 COOH) \u003d n (CH 3 COOH) * M (CH 3 COOH) \u003d y * 60 g
Sudarykime lygčių sistemą:
x + y = 0,15
60m + 46x = 7,6
Išsprendžiame sistemą: x \u003d 0,1 mol, y \u003d 0,05 mol
m (CH 3 COOH) \u003d n (CH 3 COOH) * M (CH 3 COOH) = 0,05 * 60 \u003d 3 g.
ω(CH3COOH) = m(CH3COOH)/m(mišinys) = 3/7,6 = 0,395 arba 39,5%.
Atsakymas: 39,5 proc. - Sumaišyta 100 ml 30 % perchloro rūgšties tirpalo (r = 1,11 g/ml) ir 300 ml 20 % natrio hidroksido tirpalo (r = 1,10 g/ml). Kiek mililitrų vandens reikia įpilti į gautą mišinį, kad natrio perchlorato masės dalis jame būtų 8%?
Rodyti HClO 4 + NaOH = NaClO 4 + H 2 O
m (p-p NaOH) \u003d V * ρ \u003d 300 * 1,10 \u003d 330 g.
n (NaOH) \u003d m (p-p NaOH) * ω / M = 330 * 0,2 / 40 \u003d 1,65 mol - perteklius.
m (HClO 4 tirpalas) \u003d V * ρ \u003d 100 * 1,11 \u003d 111 g.
n (HClO 4) \u003d 111 * 0,3 / 100,5 \u003d 0,331 mol,
Pagal lygtį n (HClO 4) \u003d n (NaClO 4) \u003d 0,331 mol,
m (NaClO 4) \u003d n * M = 0,331 * 122,5 \u003d 40,5 g.
Tegul įpilto vandens masė yra x g.
40,5 / (111 + 330 + x) \u003d 0,08
iš kur x = 65,3 g.
V(H2O)=65,3 ml.
Atsakymas: 65,3 ml - Į 100 ml 5% druskos rūgšties tirpalo (tankis 1,02 g/ml) įpilama 6,4 g kalcio karbido. Kiek mililitrų 15% azoto rūgšties (tankis 1,08 g/ml) reikia įpilti į gautą mišinį, kad jis visiškai neutralizuotų?
Rodyti 1) CaC 2 + 2HCl \u003d CaCl 2 + C 2 H 2
2) CaC 2 + 2H 2 O \u003d Ca (OH) 2 + C 2 H 2
3) Ca(OH) 2 + 2HNO 3 = Ca(NO 3) 2 + 2H 2 O
n (HCl) \u003d m (HCl) / M (HCl) \u003d Vp-ra (HCl) * (HCl) * p (HCl) / M (HCl) = 100 * 0,05 * 1,02 / 36,5 \u003d 0,14 mol ,
n (CaC 2) \u003d m / M \u003d 6,4 / 64 \u003d 0,1 mol.
Pagal (1) lygtį n (CaC 2) : n (HCl) = 1: 2 => CaC 2 - perteklius.
Sureagavo n (CaC 2) = n (HCl) / 2 = 0,07 mol.
Lieka n (CaC 2) \u003d 0,1 - 0,07 \u003d 0,03 mol.
Pagal (2) lygtį n (CaC 2) \u003d n (Ca (OH) 2) \u003d 0,03 mol.
Pagal (3) lygtį n(Ca(OH)2) : n(HNO3) = 1:2 =>
n (HNO 3) \u003d 2n (Ca (OH) 2) \u003d 0,06 mol.
Vr-ra (HNO 3) \u003d m (r-ra) / ρ
m (tirpalas) \u003d m (HNO 3) / ω \u003d 0,06 * 63 / 0,15 \u003d 25,2 g,
V (p-raHNO 3) \u003d 25,2 / 1,08 \u003d 23,3 ml.
Atsakymas: 23,3 ml - Natrio nitritas, sveriantis 13,8 g, buvo įpiltas kaitinant į 220 g amonio chlorido tirpalo, kurio masės dalis yra 10%. Koks tūris (N.O.) azoto išsiskirs tokiu atveju ir kokia yra amonio chlorido masės dalis gautame tirpale?
Rodyti NaNO 2 + NH 4 Cl \u003d N 2 + NaCl + 2H 2 O
n (NaNO 2) \u003d 13,8 / 69 \u003d 0,2 mol
n (NH 4 Cl) \u003d 220 0,1 / 53,5 \u003d 0,41 mol
NH 4 Cl - perteklius n (N 2) \u003d n (NaNO 2) \u003d 0,2 mol
V (N 2) \u003d 0,2 mol 22,4 l / mol \u003d 4,48 l
Apskaičiuokite likusio amonio chlorido masę:
n(NH 4 Cl) g = 0,41 - 0,2 = 0,21 mol
m (NH 4 Cl) g = 0,21 53,5 = 11,2 g Apskaičiuokite amonio chlorido masės dalį:
m(p-pa) \u003d 13,8 + 220 - 0,2 28 \u003d 228,2 g
ω (NH 4 Cl) \u003d 11,2 / 228,2 \u003d 0,049 arba 4,9 % Atsakymas:
V (N 2) \u003d 4,48 l
ω(NH 4 Cl) \u003d 4,9 % - Kalio nitritas, sveriantis 8,5 g, buvo įpiltas kaitinant į 270 g amonio bromido tirpalo, kurio masės dalis yra 12%. Koks tūris (N.O.) azoto išsiskirs šiuo atveju ir kokia yra amonio bromido masės dalis gautame tirpale?
Rodyti KNO 2 + NH 4 Br \u003d N 2 + KBr + 2H 2 O
m (in-va NH 4 Br) \u003d 270 g * 0,12 \u003d 32,4 g
n (NH 4 Br) \u003d m / M \u003d 32,4 g: 98 g / mol \u003d 0,33 mol
n(KNO 2) \u003d m / M \u003d 8,5 g: 85 g / mol \u003d 0,1 mol
n(NH4), proreakt. su KNO 2 \u003d 0,33 mol - 0,1 mol \u003d 0,23 mol (nes n (KNO 2) : n (NH 4 Br) \u003d 1: 1)
m (NH 4 Br), likęs galutiniame tirpale \u003d n * M \u003d 0,23 mol * 98 g / mol \u003d 22,54 g
n (N 2) \u003d n (KNO 2) \u003d 0,1 mol
(N 2) \u003d n * M \u003d 0,1 mol * 28 g / mol \u003d 2,8 g
V (N 2) \u003d n * M \u003d 0,1 mol * 22,4 l / mol \u003d 2,24 l
m (galutinis tirpalas) \u003d m (KNO 2) + m (NH 4 Br tirpalas) - m (N 2) \u003d 8,5 g + 270 g - 2,8 g \u003d 275,7 g
W (NH 4 Br galutiniame tirpale) = 22,54 g: 275,7 g = 8 %
Atsakymas: V (N 2) \u003d 2,24 l; W(NH 4 Br) = 8 % - Sumaišoma 300 ml sieros rūgšties tirpalo, kurio masės dalis yra 10% (tankis 1,05 g/ml) ir 200 ml kalio hidroksido tirpalo, kurio masės dalis yra 20% (tankis 1,10 g/ml). Kiek mililitrų vandens reikia įpilti į gautą mišinį, kad druskos masės dalis jame būtų 7%?
- 120 ml azoto rūgšties tirpalo, kurio masės dalis yra 7% (tankis 1,03 g/ml), buvo gauta 12,8 g kalcio karbido. Kiek mililitrų 20% druskos rūgšties (tankis 1,10 g/ml) reikia įpilti į gautą mišinį, kad jis visiškai neutralizuotų?
Rodyti 1) CaC 2 + 2HNO 3 \u003d Ca (NO 3) 2 + C 2 H 2.
n (CaC 2) \u003d 12,8 / 64 \u003d 0,2 mol
n (HNO 3) \u003d (0,07 1,03 120) / 63 \u003d 0,137 mol
CaC 2 - perteklius. 2) CaC 2 + 2H 2 O \u003d Ca (OH) 2 + C 2 H 2.
n (Ca (OH) 2) \u003d 0,2 - 0,137 / 2 \u003d 0,13 mol 3) Ca (OH) 2 + 2HCl \u003d CaCl 2 + 2H 2 O.
n(HCl) \u003d 0,13 2 \u003d 0,26 mol
m (tirpalas) \u003d m (HCl) / w \u003d (0,26 36,5) / 0,2 \u003d 47,45 g
V (HCl tirpalas) \u003d m (tirpalas) / ρ \u003d 47,45 / 1,10 \u003d 43,1 ml.
Atsakymas: 43,1 ml. - Į tirpalą, gautą į 100 ml vandens įpylus 4 g kalio hidrido, įpilama 100 ml 39 % azoto rūgšties tirpalo (r = 1,24 g/ml). Nustatykite visų medžiagų (įskaitant vandenį) masės dalis galutiniame tirpale.
Rodyti KH + H 2 O \u003d KOH + H 2
n(KH) = 4 g: 40 g/mol = 0,1 mol
n(H2O) \u003d 100 g: 18 g / mol \u003d 5,6 mol
KH trūksta, tada n (KOH) \u003d n (KH) \u003d 0,1 molKOH + H 2 NO 3 \u003d KNO 3 + H 2 O
a) m(KOH) = 0,1 * 56 = 5,6
b) m in-va (HNO 2) \u003d 100 ml * 1,24 g / ml * 0,39 \u003d 48,36 g
n (HNO 3) \u003d 48,36 g: 63 g / mol \u003d 0,77 mol
HNO 3 perteklius, n perteklius (HNO 3) \u003d 0,77 - 0,1 \u003d 0,67 mol
m (HNO 3) \u003d 0,67 * 63 \u003d 42,21 g
m (tirpalas) \u003d 4g + 100g + 124g - 0,2g \u003d 227,8g
3) W (KNO 3) \u003d m (KNO 3) : m (p-pa) \u003d (0,1 mol * 101 g / mol) 227,8 g * 100% \u003d 4,4%
W (HNO 3) \u003d 42,21: 227,8 * 100 % \u003d 18,5
W (H 2 O) \u003d 100 % - (W (KNO 3) + W (HNO 3)) \u003d 77,1 %
Atsakymas:
W(KNO 3) = 4,4 %
W(HNO 3) \u003d 18,5 %
W(H2O) = 77,1 %1) 2Na 2 O 2 + 2H 2 O \u003d 4NaOH + O 2
2) 2NaOH + H2SO4 = Na2SO4 + 2H2O
m (H 2 SO 4 tirpalas) \u003d 300 * 1,08 \u003d 324 g
m (H 2 SO 4) \u003d 0,1 * 324 \u003d 32,4 g
n (H 2 SO 4) \u003d 32,4 / 98 \u003d 0,33 mol
n(NaOH): n(H2SO4) = 2:1 => n(NaOH) = 0,33 * 2 = 0,66 mol
n(Na 2 O 2): n(NaOH) = 1:2 => n(Na2O2) = 0,66/2 = 0,33 mol
m (Na 2 O 2) \u003d n * M = 0,33 * 78 \u003d 25,7 g
n(Na2O2): n(O2) = 2:1 => n(O2) = 0,33/2 = 0,165 mol
V (O 2) \u003d 0,165 * 22,4 \u003d 3,7 l
Atsakymas: m (Na 2 O 2) \u003d 25,7 g; V (O 2) \u003d 3,7 l - Kaitinamas kalio bikarbonatas virsta karbonatu. Apskaičiuokite kalio bikarbonato masės dalį pradiniame tirpale, kurį kaitinant galite gauti 8% kalio karbonato tirpalą.
- Sąveikaujant sieros rūgšties terpėje, išsiskyrė 17,4 g mangano dioksido su 58 g kalio bromido, bromo išeiga 77%. Koks tūris (N.O.) propeno gali reaguoti su gautu bromo kiekiu?
- 5,6 l (n.o.) tūrio anglies dioksidas buvo praleistas per 164 ml 20 % natrio hidroksido tirpalo (ρ = 1,22 g/ml). Nustatykite medžiagų sudėtį ir masės dalis gautame tirpale.
- Aliuminio karbidas buvo ištirpintas 15% sieros rūgšties tirpale, sveriančiame 300 g. Tuo pačiu metu išsiskyręs metanas užėmė 2,24 l (n.o.) tūrį. Apskaičiuokite sieros rūgšties masės dalį gautame tirpale.
- Esant deguonies pertekliui, sudegė 8 g sieros. Gautos dujos praleidžiamos per 200 g 8% natrio hidroksido tirpalo. Gautame tirpale nustatykite druskų masės dalis.
- Aliuminio ir geležies drožlių mišinys buvo apdorotas praskiestos druskos rūgšties pertekliumi ir išsiskyrė 8,96 l (n.o.) vandenilio. Jei ta pati masė mišinio apdorojama natrio hidroksido tirpalo pertekliumi, išsiskirs 6,72 litro (N.O.) vandenilio. Apskaičiuokite geležies masės dalį pradiniame mišinyje.
- Magnio ir cinko drožlių mišinys buvo apdorotas praskiestos sieros rūgšties pertekliumi ir išsiskyrė 22,4 litro (n.o.) vandenilio. Jei ta pati masė mišinio apdorojama natrio šarmo tirpalo pertekliumi, tuomet išsiskirs 13,44 l (n.o.) vandenilio. Apskaičiuokite magnio masės dalį pradiniame mišinyje.
2KHCO 3 + H 2 SO 4 = K 2 SO 4 + 2CO 2 + 2H 2 O (2) Na 2 CO 3 + 2HCl \u003d NaCl + CO 2 + H 2 O
NaHCO 3 + HCl \u003d NaCl + CO 2 + H 2 O
NaHCO 3 + NaOH \u003d Na 2 CO 3 + H 2 O
1) rastisumaNaHCO3
n(NaOH)=(NaHCO3)=m(NaOH) . ω (NaOH) / M (NaOH) \u003d 80 * 0,1 / 40 \u003d 0,2 mol
2) rastimasėNaHCO3
m(NaHCO3)=n(NaHCO3)*M(NaHCO3)=0,2. 84=16,8 g
3) Raskite Na 2 CO 3 kiekį
n(HCl) = m(HCl) . ω (HCl) / M (HCl) \u003d 73 * 0,2 / 36,5 \u003d 0,4 mol
n (Na 2 CO 3) \u003d (n (HCl) - n (NaOH)) / 2 \u003d 0,1 mol
4) rasti masęNa 2 CO 3
m(Na2CO3)=n. M = 0,1. 106 = 10,6 g
5) raskite masės dalįNa2CO3
ω (Na 2 CO 3) \u003d m (Na 2 CO 3) / m (mišinys) . 100 % = 38,7 %
m(mišinys).=m(Na2CO3)+m(NaHCO3)=27,4 g
Atsakymas: ω (Na 2 CO 3) \u003d 38,7 %1) 2Na + 2H2O → 2NaOH + H2
2) Na 2 O + H 2 O → 2NaOH
1) rasti kiekįNa
n(H 2) \u003d V / Vm \u003d 4,48 / 22,4 \u003d 0,2 mol
Pagal (1) lygtį n (Na) \u003d n 1 (NaOH) \u003d 2. n(H2) = 0,4 mol
2) raskite masęNa
m(Na) = n . M = 0,4. 23 = 9,2 g
3) rasti kiekįNaOH
n(NaOH) = m(p-p) . ω/M(NaOH) = 240 um. 0,1/40 = 0,6 mol
4) rasti kiekįNa 2 O
n (Na 2 O) \u003d (n (NaOH) - n 1 (NaOH)) / 2 \u003d 0,1 mol
m(Na2O)= n. M = 0,1. 62 = 6,2 g
5) rastimmasinė dalisNa
ω (Na) = m(Na)/m(mišiniai) . 100 % = 59,7 %
m(mišinys)=m(Na)+m(Na2O)=15,4
Atsakymas: ω (Na)=59,7%
1) Raskite bendrą sumąH2SO4
n 1 (H 2 SO 4) \u003d m. ω/M=490 . 0,4/98=2 mol
M (H 2 SO 4) \u003d 2 + 32 + 64 \u003d 98 g / mol
2) RaskimeH2SO4sureagavoSuNa2CO3
n (Na 2 CO 3) \u003d n (Na 2 CO 3. 10H 2 O) \u003d m / M \u003d 143/286 \u003d 0,5 mol
M (Na 2 CO 3. 10H 2 O) \u003d (46 + 12 + 48) + (10, 18) \u003d 286 g / mol
Pagal lygtį n (H 2 SO 4) \u003d n (Na 2 CO 3) \u003d 0,5 mol
3) rastiH 2 TAIP 4 sureagavo suNaOH
n (H 2 SO 4) \u003d n 1 -n \u003d 2-0,5 \u003d 1,5 mol
4) Raskite NaOH masę
n(NaOH)=2n(H2SO4)=2. 1,5=3 mol
m(NaOH)=n. M = 3. 40=120 g
M(NaOH)=23+16+1=18 g/mol
5) raskite masės dalįNaOH
ω (NaOH) \u003d m (medžiaga) / . m(p-p)*100%=120/1200 . 100 % = 10 %
Atsakymas: m(NaOH)=120g; ω(NaOH)=10 %
48) Magnio ir aliuminio drožlių mišinys buvo apdorotas praskiestos druskos rūgšties pertekliumi ir išsiskyrė 11,2 litro (n.o.) vandenilio. Jei tokia pati mišinio masė apdorojama kalio hidroksido tirpalo pertekliumi, išsiskirs 6,72 litro (N.O.) vandenilio. Apskaičiuokite magnio masės dalį pradiniame mišinyje.
49) Kalcio karbidas, sveriantis 6,4 g, buvo ištirpintas 87 ml vandenilio bromido rūgšties (ρ = 1,12 g / ml), kurios masės dalis yra 20%. Kokia yra vandenilio bromido masės dalis gautame tirpale?
Šioje užduotyje yra dvi lygiagrečios reakcijos, susijusios su medžiagų mišiniu.
3.9 problema.
7,6 g skruzdžių ir acto rūgščių mišinio neutralizuoti buvo panaudota 35 ml 20 % kalio hidroksido tirpalo (p = 1,2 g/ml). Apskaičiuokite acto rūgšties masę ir jos masės dalį pradiniame rūgščių mišinyje.
Duota:
rūgščių mišinio masė: m (rūgšties mišinys) = 7,6 g;
KOH tirpalo tūris: V tirpalas (KOH) = 35 ml;
KOH masės dalis pradiniame tirpale: (KOH) nuorodoje. p-re = 20%;
pradinio KOH tirpalo tankis: p ref. tirpalas (KOH) = 1,2 g / ml.
Rasti: acto rūgšties masė: m(CH 3 COOH);
CH 3 COOH masės dalis pradiniame mišinyje: (CH 3 COOH) =?
Sprendimas:
Kai rūgščių mišinys sąveikauja su kalio hidroksidu, vienu metu vyksta dvi reakcijos:
CH 3 COOH + KOH → CH 3 COOK + H 2 O
HCOOH + KOH → LCOOK + H 2 O
Uždavinį galima išspręsti pagal skaitiklio algoritmą sudarant matematinę lygtį. Sprendimo schemą galima pavaizduoti taip:

1. Acto rūgšties masę pradiniame mišinyje pažymėkite reikšme "a":
m (CH 3 COOH) \u003d a g.
Tada skruzdžių rūgšties masę galima nustatyti pagal skirtumą:
m (HCOOH) \u003d m (rūgščių mišiniai) - m (CH 3 COOH) \u003d (7,6 - a) g.
2. Naudodami acto rūgšties reakcijos su šarmo tirpalu lygtį, nustatome KOH masę, kuri buvo sunaudota šioje sąveikoje.

3. Panašiai pagal reakcijos lygtį su skruzdžių rūgštimi randame KOH masę, kuri buvo sunaudota antroje sąveikoje.

4. Rasti Bendras svoris KOH, kuris buvo sunaudotas vykdant dvi reakcijas:
m (KOH) \u003d m (KOH) rajone su ux prie vieno + m (KOH) rajone su mur prie vieno \u003d
= 0,933. a + (9,25 - 1,217. a) \u003d (9,25 - 0,284. a) g.
5. Raskite KOH masę, kuri buvo 200 ml pradinio tirpalo:

6. 4 veiksme gautą išraišką prilyginkite KOH masės reikšmei iš 5 veiksmo:
9,25 - 0,284. a = 8,4.
Gavote matematinę lygtį. Išspręsdami ją, randame reikšmės "a" reikšmę:
"a" reikšmė žymėjo acto rūgšties masę:
m (CH 3 COOH) \u003d 3 g.
7. Raskite CH 3 COOH masės dalį pradiniame rūgščių mišinyje
Atsakymas: m(CH3COOH) = 3 g; (CH3COOH) = 39,5 %.









Kokybės reikalavimai
Durpių ištekliai Frezų durpių gavyba
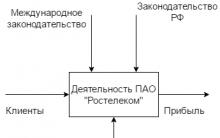
Uždaroji akcinė bendrovė „Transtelecom“.
„Wi-Fi“ įrangos nustatymas
Pasterizavimo stalčius „galvų“ atrinkimui rektifikacijos metu