Vous devez d’abord vous assurer que la réaction présentée dans l’équation est ORR (réaction Redox). Il ne faut pas oublier que les réactions OVR n'incluent pas les processus métaboliques. Note H2SO4 + NaOH → Na2SO4 + H2O – réaction d'échange, les états d'oxydation ne changent pas.
Étape 2
Après nous être assurés qu'il s'agit d'un OVR, nous procéderons à l'agencement des coefficients. Vous devez d’abord organiser les nombres d’oxydation pour chaque élément de la réaction. Voir la figure 2.
Vous pouvez voir que dans certains éléments, l’état d’oxydation a changé. La méthode du bilan consiste à utiliser un changement des états d’oxydation.
Étape 3
Maintenant la balance électronique elle-même.
Cela se fait généralement comme ceci : Voir Fig.3.
Remarque : Vous devez définir les coefficients s'ils sont requis.
Maintenant, je vais expliquer ce qui s'est passé ici, l'azote (N) avait trois électrons supplémentaires (¯e) dans la réaction, il perd tous les électrons supplémentaires.
Avec l'oxygène (O2), c'est le contraire qui se produit : il gagne des électrons, car dans les composés, il prend les électrons des autres éléments.
En conséquence, nous avons deux nombres - 6 et 4, ils sont des multiples de 2, nous obtenons 3 et 2. Ensuite, nous changeons de place (Pourquoi ? Ne pensez même pas pourquoi =)). Ces deux chiffres nous aideront à égaliser notre réaction.
Méthode de balance électronique
Méthode de balance électronique- une des méthodes d'égalisation des réactions d'oxydo-réduction (ORR). Elle consiste à attribuer des coefficients dans l'ORR en fonction des états d'oxydation. Pour une égalisation correcte, une certaine séquence d'actions doit être suivie :
- Trouvez l’agent oxydant et l’agent réducteur.
- Établissez pour eux des diagrammes (demi-réactions) de transitions électroniques qui correspondent à ce processus redox.
- Égalisez le nombre d'électrons donnés et reçus dans des demi-réactions.
- Résumez séparément les parties gauche et droite des demi-réactions.
- Disposez les coefficients dans l’équation de la réaction redox.
Regardons maintenant un exemple spécifique
Étant donné la réaction : Li + N 2 = Li 3 N
1. Trouvez l’agent oxydant et l’agent réducteur :
Li 0 + N 2 0 = Li 3 +1 N −3
N gagne des électrons, c'est un agent oxydant
Li donne des électrons, c'est un agent réducteur
2. Composez des demi-réactions :
Li 0 - 1e = Li +1
N 2 0 + 6e = 2N −3
3. Égalisons maintenant le nombre d’électrons donnés et reçus dans la demi-réaction :
6* |Li0 - 1e = Li +1
1* |N 2 0 + 6e = 2N −3
On a:
6Li 0 - 6e = 6Li +1
N 2 0 + 6e = 2N −3
4. Résumons séparément les parties gauche et droite des demi-réactions :
6Li + N2 = 6Li +1 + 2N −3
5. Organisons les coefficients de la réaction redox :
6Li + N2 = 2Li3N
Regardons un exemple plus complexe
Étant donné la réaction : FeS + O 2 = Fe 2 O 3 + SO 2
À la suite de la réaction, les atomes de fer sont oxydés, les atomes de soufre sont oxydés et les atomes d'oxygène sont réduits.
1. Nous notons les demi-réactions pour le soufre et le fer :
Fe +2 - 1e = Fe +3
S −2 - 6e = S +4
Le total pour les deux processus peut s’écrire comme suit :
Fe +2 + S −2 - 7e = Fe +3 + S +4
Nous notons la demi-réaction pour l'oxygène :
O 2 +4e = 2O −2
2. Nous égalisons le nombre d'électrons donnés et acceptés dans deux demi-réactions :
4*| Fe +2 + s −2 - 7e = Fe +3 + S +4
7*| O 2 + 4e = 2O −2
3. Résumons les deux demi-réactions :
4Fe +2 + 4S −2 + 7O 2 = 4Fe +3 + 4S +4 + 14O −2
4. Organisons les coefficients de la réaction redox :
4FeS + 7O 2 = 2Fe 2 O 3 + 4SO 2
Fondation Wikimédia. 2010.
Découvrez ce qu'est la « Méthode de balance électronique » dans d'autres dictionnaires :
Une équation chimique (équation d'une réaction chimique) est une représentation conventionnelle d'une réaction chimique utilisant des formules chimiques, des coefficients numériques et des symboles mathématiques. L'équation d'une réaction chimique donne des résultats qualitatifs et quantitatifs... ... Wikipédia
Les réactions redox sont des réactions chimiques accompagnées d'une modification des indices d'oxydation (voir Indice d'oxydation) des atomes. Initialement (dès l'introduction de la théorie de la combustion de l'oxygène en chimie par A. Lavoisier, fin du XVIIIe siècle) ... ...
Oxydo-réduction, réactions redox, réactions chimiques accompagnées d'une modification du nombre d'oxydation des atomes. Initialement (depuis l'introduction de la théorie de la combustion de l'oxygène en chimie par A. Lavoisier, fin du XVIIIe siècle)... ... Grande Encyclopédie Soviétique
Technique permettant d'obtenir de manière répétée des images (impressions) identiques en transférant une couche d'encre d'une plaque d'impression sur du papier ou un autre matériau. Le processus réel de transfert d’une image d’une plaque d’impression sur du papier est appelé impression. Mais ça… … Encyclopédie de Collier
Mathématiques La recherche scientifique dans le domaine des mathématiques a commencé à être menée en Russie au XVIIIe siècle, lorsque L. Euler, D. Bernoulli et d'autres scientifiques d'Europe occidentale sont devenus membres de l'Académie des sciences de Saint-Pétersbourg. Selon le plan de Pierre Ier, les académiciens sont des étrangers... ... Grande Encyclopédie Soviétique
Monnaie électronique- (Monnaie électronique) La monnaie électronique désigne les obligations monétaires de l'émetteur sous forme électronique. Tout ce que vous devez savoir sur la monnaie électronique, l'histoire et l'évolution de la monnaie électronique, le transfert, l'échange et le retrait de monnaie électronique dans divers systèmes de paiement... Encyclopédie des investisseurs
système- 4.48 système : combinaison d'éléments en interaction organisés pour atteindre un ou plusieurs objectifs spécifiés. Note 1 Un système peut être considéré comme un produit ou les services qu'il fournit. Remarque 2 En pratique... ... Dictionnaire-ouvrage de référence des termes de la documentation normative et technique
Politique de crédit d'argent- (Politique monétaire) Le concept de politique monétaire, les objectifs de la politique monétaire Informations sur le concept de politique monétaire, les objectifs de la politique monétaire Sommaire >>>>>>>>>> ... Encyclopédie des investisseurs
Stocks de gros- (Stocks de gros) Détermination des stocks de gros, des stocks commerciaux et d'entrepôt Informations sur la détermination des stocks de gros, des stocks commerciaux et d'entrepôt Sommaire Sommaire Types de stocks et leurs caractéristiques Stocks commerciaux et d'entrepôt Principes... ... Encyclopédie des investisseurs
Récession- (Récession) Sommaire >>>>>>>>> La récession est une définition de la productivité qui caractérise un indicateur principal nul ou négatif du produit intérieur brut, survenant pendant six mois ou plus... Encyclopédie des investisseurs
La tâche a été confiée : « Utilisez ces diagrammes pour créer des diagrammes de balance électronique. » Comment faire? Que faudra-t-il ? Essayons de le comprendre ensemble.
L'essence de la méthode
Voyons d’abord ce qu’est cette méthode. Si le diagramme de balance électronique est établi correctement, tous les coefficients stéréochimiques peuvent être définis dans la réaction proposée.
L'essence de cette technique est de déterminer les états d'oxydation des éléments individuels ayant participé à la réaction. Si l'élément reste constant sur les côtés gauche et droit de l'équation, alors le schéma de la balance électronique est établi sans lui.
Pour les éléments qui ont changé leur état d'oxydation lors de l'interaction, les valeurs obtenues sont prises en compte lors du calcul du plus petit commun multiple.

Comment faire un équilibre
Pour commencer, vous devrez attribuer à chaque élément son état d’oxydation, en utilisant certaines règles. Si une substance simple interagit, elle n'accepte pas et ne cède pas d'électrons à un autre élément, par conséquent, son état d'oxydation est zéro. Des exemples de composés avec un état d’oxydation nul sont les molécules halogènes et les métaux.
Dans un composé binaire, l'état d'oxydation du deuxième élément est négatif et l'état d'oxydation du premier est positif. Le total (en tenant compte du nombre d’atomes) doit être nul. Dans l'oxyde de calcium, par exemple, le premier élément a un état d'oxydation de +2 et le second (l'oxygène) a un état d'oxydation de -2. Leur valeur totale est nulle puisque la molécule est neutre.
S'il est nécessaire de disposer les états d'oxydation dans une substance plus complexe, déterminez d'abord les indicateurs du premier et du dernier élément. Ensuite, à l’aide de calculs mathématiques, l’état d’oxydation de l’élément central est déterminé. La somme de tous les indicateurs doit être égale à zéro.

Algorithme d'actions
Comment est établi un schéma de bilan électronique ? Sur le côté gauche, les éléments qui ont participé au processus redox sont notés ainsi que leurs états d'oxydation.
Ensuite, les signes « plus » et « moins » indiquent le nombre d’électrons acceptés et abandonnés lors de l’interaction chimique. Entre est déterminé par le plus petit commun multiple. Rappelons que cela signifie un nombre positif qui sera divisible par les deux chiffres concernant les électrons sans reste.
Un schéma de balance électronique est considéré comme complet si les coefficients y sont également définis. Comment les trouver ? doit être divisé en électrons reçus et donnés au cours du processus. Les nombres résultants seront des coefficients stéréochimiques.
Il est également important de déterminer l'agent réducteur et oxydant, ainsi que les processus se produisant lors de l'interaction (oxydation et réduction). Le schéma résultant de la balance électronique du processus redox vous permettra de placer les coefficients manquants dans la réaction.

Tâches pour OVR dans la certification finale
Sur la base de cette méthode, les diplômés sont invités à réaliser une tâche du niveau « C ». La réussite dépend du niveau de compétences pratiques de l'étudiant et du degré de maîtrise des fondamentaux théoriques.
Par exemple, la tâche dit : à l'aide de ces schémas, créez des schémas de balance électronique. De plus, certains réactifs, ainsi que certains produits d'interaction, peuvent manquer. Cette question est considérée comme une tâche d'une complexité accrue et nécessite donc une certaine séquence de raisonnement.
Pour commencer, les états d'oxydation de tous les éléments des substances connues sont déterminés, puis les substances manquantes dans les deux parties de la réaction sont notées.
Dans les tests d'examen d'État unifié en chimie, on suppose un enregistrement séparé des substances directement impliquées dans l'équation, suivi d'une indication de l'agent oxydant et de l'agent réducteur.
Conclusion
Cette méthode est loin d'être la seule façon d'attribuer des coefficients dans une équation. Vous pouvez également l'utiliser, ce qui vous permet d'égaliser simultanément toutes les substances écrites dans l'équation.
Livre de problèmes sur la chimie générale et inorganique
2.2. Réactions redox
Regarder Tâches >>>Partie théorique
Les réactions redox comprennent des réactions chimiques qui s'accompagnent d'une modification des états d'oxydation des éléments. Dans les équations de telles réactions, la sélection des coefficients s'effectue en compilant balance électronique. La méthode de sélection des cotes à l'aide d'une balance électronique comprend les étapes suivantes :
a) écrire les formules des réactifs et des produits, puis trouver les éléments qui augmentent et diminuent leurs états d'oxydation et les écrire séparément :
MnCO 3 + KClO 3 ® MnO2+ KCl + CO2
Classe V¼ = Cl - je
MnII¼ = MnIV
b) composer des équations pour les demi-réactions de réduction et d'oxydation, en respectant les lois de conservation du nombre d'atomes et de la charge dans chaque demi-réaction :
demi-réaction récupération Classe V + 6 e - = Cl - je
demi-réaction oxydation MnII- 2 e - = MnIV
c) des facteurs supplémentaires sont sélectionnés pour l'équation des demi-réactions de manière à ce que la loi de conservation de la charge soit satisfaite pour la réaction dans son ensemble, pour laquelle le nombre d'électrons acceptés dans les demi-réactions de réduction est rendu égal au nombre de électrons donnés lors de la demi-réaction d'oxydation :
Classe V + 6 e - = Cl - Je 1
MnII- 2 e - = MnIV 3
d) insérer (en utilisant les facteurs trouvés) des coefficients stoechiométriques dans le schéma de réaction (le coefficient 1 est omis) :
3 MnCO 3 + KClO 3 = 3 MnO 2 + KCl+CO2
d) égalisez le nombre d'atomes de ces éléments qui ne changent pas leur état d'oxydation au cours de la réaction (s'il existe deux de ces éléments, il suffit alors d'égaliser le nombre d'atomes de l'un d'eux et de vérifier le second). L’équation de la réaction chimique est obtenue :
3 MnCO 3 + KClO 3 = 3 MnO 2 + KCl+ 3 CO2
Exemple 3. Sélectionnez les coefficients dans l'équation de la réaction redox
Fe 2 O 3 + CO ® Fe + CO2
Solution
Fe 2 O 3 + 3 CO = 2 Fe +3 CO 2
FeIII + 3 e - = Fe 0 2
CII - 2 e - = C IV 3
Avec l'oxydation (ou la réduction) simultanée des atomes de deux éléments d'une substance, le calcul est effectué pour une unité de formule de cette substance.
Exemple 4. Sélectionnez les coefficients dans l'équation de la réaction redox
Fe(S ) 2 + O 2 = Fe 2 O 3 + SO 2
Solution
4Fe(S ) 2 + 11 O 2 = 2 Fe 2 O 3 + 8 SO 2
FeII- e - = FeIII
- 11 e - 4
2S - je - 10 e - = 2SIV
O 2 0 + 4 e - = 2O - II+4 e - 11
Dans les exemples 3 et 4, les fonctions de l'agent oxydant et réducteur sont réparties entre différentes substances, Fe 2 O 3 et O 2 - agents oxydants, CO et Fe(S)2 - les agents réducteurs; De telles réactions sont classées comme intermoléculaire Réactions redox.
Quand intramoléculaire oxydo-réduction, lorsque dans la même substance les atomes d'un élément sont oxydés et les atomes d'un autre élément sont réduits, le calcul est effectué pour une unité de formule de la substance.
Exemple 5. Sélectionnez les coefficients dans l'équation de la réaction d'oxydo-réduction
(NH 4) 2 CrO 4 ® Cr 2 O 3 + N 2 + H 2 O + NH 3
Solution
2 (NH 4) 2 CrO 4 = Cr 2 O 3 + N 2 +5 H 2 O + 2 NH 3
Cr VI + 3 e - = Cr III 2
2N - III - 6 e - = N 2 0 1
Pour les réactions dismutation (disproportion, autooxydation- auto-cicatrisant), dans lequel les atomes du même élément dans le réactif sont oxydés et réduits, des facteurs supplémentaires sont d'abord ajoutés au côté droit de l'équation, puis le coefficient du réactif est trouvé.
Exemple 6. Sélectionnez les coefficients dans l'équation de réaction de dismutation
H2O2 ® H2O+O2
Solution
2 H 2 O 2 = 2 H 2 O + O 2
Ô - Je+ e - =O - II2
2O - je - 2 e - = O 2 0 1
Pour la réaction de commutation ( synproportion), dans lequel les atomes du même élément de différents réactifs, à la suite de leur oxydation et de leur réduction, reçoivent le même état d'oxydation, des facteurs supplémentaires sont d'abord ajoutés au côté gauche de l'équation.
Exemple 7. Sélectionnez les coefficients dans l'équation de réaction de commutation :
H 2 S + SO 2 = S + H 2 O
Solution
2H2S + SO2 = 3S + 2H2O
S - II - 2 e - = S 0 2
SIS+4 e - = S 0 1
Pour sélectionner les coefficients dans les équations des réactions redox se produisant dans une solution aqueuse avec la participation d'ions, la méthode est utilisée équilibre électron-ion. La méthode de sélection des coefficients par balance électron-ion comprend les étapes suivantes :
a) noter les formules des réactifs de cette réaction redox
K 2 Cr 2 O 7 + H 2 SO 4 + H 2 S
et établir la fonction chimique de chacun d'eux (ici K2Cr2O7 - agent oxydant, H 2 SO 4 - milieu réactionnel acide, H2S - agent réducteur);
b) notez (sur la ligne suivante) les formules des réactifs sous forme ionique, en indiquant uniquement les ions (pour les électrolytes forts), les molécules (pour les électrolytes et les gaz faibles) et les unités de formule (pour les solides) qui participeront au réaction en tant qu'agent oxydant ( Cr2O72 - ), environnement ( H+- plus précisément, le cation oxonium H3O+ ) et agent réducteur ( H2S) :
Cr2O72 - +H++H2S
c) déterminer la formule réduite de l'oxydant et la forme oxydée du réducteur, qui doivent être connues ou précisées (par exemple, ici l'ion dichromate laisse passer les cations chrome ( III) et du sulfure d'hydrogène - en soufre); Ces données sont écrites sur les deux lignes suivantes, les équations électron-ion pour les demi-réactions de réduction et d'oxydation sont établies et des facteurs supplémentaires sont sélectionnés pour les équations de demi-réaction :
demi-réaction réduction de Cr 2 O 7 2 - + 14H + + 6 e - = 2 Cr 3+ + 7 H 2 O 1
demi-réaction oxydation de H 2 S - 2 e - = S (t) + 2 H + 3
d) composer, en additionnant les équations de demi-réaction, l'équation ionique d'une réaction donnée, c'est-à-dire compléter l'entrée (b) :
Cr2O72 - + 8 H + + 3 H 2 S = 2 Cr 3+ + 7 H 2 O + 3 S ( T)
d) basée sur l'équation ionique, constituent l'équation moléculaire de cette réaction, c'est-à-dire Complétez l'entrée (a), et les formules des cations et des anions manquant dans l'équation ionique sont regroupées dans les formules des produits supplémentaires ( K2SO4) :
K 2 Cr 2 O 7 + 4H 2 SO 4 + 3H 2 S = Cr 2 (SO 4) 3 + 7H 2 O + 3S ( t ) + K 2 SO 4
f) vérifier les coefficients sélectionnés par le nombre d'atomes des éléments des côtés gauche et droit de l'équation (il suffit généralement de vérifier uniquement le nombre d'atomes d'oxygène).
OxydéEt restauré Les formes oxydantes et réductrices diffèrent souvent par leur teneur en oxygène (comparer Cr2O72 - et Cr 3+ ). Par conséquent, lors de la compilation d'équations de demi-réaction à l'aide de la méthode de la balance électron-ion, elles incluent les paires H + / H 2 O (pour un milieu acide) et OH - / H 2 O (pour un environnement alcalin). Si, lors du passage d'un formulaire à un autre, le formulaire original (généralement - oxydé) perd ses ions oxydes (indiqués ci-dessous entre crochets), alors ces derniers, puisqu'ils n'existent pas sous forme libre, doivent être combinés avec des cations hydrogène en milieu acide, et en milieu alcalin - avec des molécules d'eau, ce qui conduit à la formation de molécules d'eau (en milieu acide) et d'ions hydroxyde (en milieu alcalin):
environnement acide[ O2 - ] + 2 H + = H 2 O
environnement alcalin[ O 2 - ] + H 2 O = 2 OH -
Manque d'ions oxyde dans leur forme originale (généralement- en réduit) par rapport à la forme finale est compensé par l'ajout de molécules d'eau (en milieu acide) ou d'ions hydroxydes (en milieu alcalin) :
environnement acide H 2 O = [ O 2 - ] + 2 H +
environnement alcalin2 OH - = [ O 2 - ] + H 2 O
Exemple 8. Sélectionnez les coefficients à l'aide de la méthode de la balance électron-ion dans l'équation de la réaction redox :
® MnSO 4 + H 2 O + Na 2 SO 4 + ¼
Solution
2 KMnO 4 + 3 H 2 SO 4 + 5 Na 2 SO 3 =
2 MnSO 4 + 3 H 2 O + 5 Na 2 SO 4 + + K 2 SO 4
2MnO4 - + 6 H + + 5 SO 3 2 - = 2 Mn 2+ + 3 H 2 O + 5 SO 4 2 -
MnO4 - + 8H + + 5 e - = Mn 2+ + 4 H 2 O2
DONC 3 2 - +H2O - 2 e - = DONC 4 2 - + 2 H + 5
Exemple 9. Sélectionnez les coefficients à l'aide de la méthode de la balance électron-ion dans l'équation de la réaction redox :
Na 2 SO 3 + KOH + KMnO 4 ® Na 2 SO 4 + H 2 O + K 2 MnO 4
Solution
Na 2 SO 3 + 2 KOH + 2 KMnO 4 = Na 2 SO 4 + H 2 O + 2 K 2 MnO 4
DONC 3 2 - + 2 OH - + 2 MnO 4 - = DONC 4 2 - + H 2 O + 2 MnO 4 2 -
MnO4 - + 1 e - = MnO 4 2 - 2
DONC 3 2 - + 2 OH - - 2 e - = DONC 4 2 - + H2O1
Si l'ion permanganate est utilisé comme agent oxydant dans un environnement faiblement acide, alors l'équation de la demi-réaction de réduction est :
MnO4 - + 4 H + + 3 e - = MnO2( t) + 2H2O
et si dans un environnement légèrement alcalin, alors
MnO 4 - + 2H2O + 3 e - = MnO2( t) + 4 OH -
Souvent, un milieu légèrement acide et légèrement alcalin est classiquement appelé neutre, et seules les molécules d'eau sont introduites dans les équations de demi-réaction de gauche. Dans ce cas, lors de la composition de l'équation, vous devez (après avoir sélectionné des facteurs supplémentaires) écrire une équation supplémentaire reflétant la formation d'eau à partir des ions H + et OH. - .
Exemple 10. Sélectionnez les coefficients dans l'équation de la réaction se produisant en milieu neutre :
KMnO 4 + H 2 O + Na 2 SO 3 ® MnÀ PROPOS 2( t) + Na 2 SO 4 ¼
Solution
2 KMnO 4 + H 2 O + 3 Na 2 SO 3 = 2 MnO2( t) + 3 Na 2 SO 4 + 2 KOH
MnO4 - + H 2 O + 3 SO 3 2 - = 2 MnO2( t ) + 3 ALORS 4 2 - + 2 OH -
MnO 4 - + 2H2O + 3 e - = MnO2( t) + 4 OH -
DONC 3 2 - +H2O - 2 e - = DONC 4 2 - +2H+
8OH - + 6 H + = 6 H 2 O + 2 OH -
Ainsi, si la réaction de l'exemple 10 est réalisée en combinant simplement des solutions aqueuses de permanganate de potassium et de sulfite de sodium, elle se déroule alors dans un environnement conditionnellement neutre (et en fait légèrement alcalin) en raison de la formation d'hydroxyde de potassium. Si la solution de permanganate de potassium est légèrement acidifiée, la réaction se déroulera dans un environnement faiblement acide (conditionnellement neutre).
Exemple 11. Sélectionnez les coefficients dans l'équation de la réaction se produisant dans un environnement faiblement acide :
KMnO 4 + H 2 SO 4 + Na 2 SO 3 ® MnÀ PROPOS 2( t) + H 2 O + Na 2 SO 4 + ¼
Solution
2KMnO 4 + H 2 SO 4 + 3Na 2 SO 3 = 2Mn O2( T) + H 2 O + 3Na 2 SO 4 + K 2 SO 4
2MnO4 - + 2 H + + 3 SO 3 2 - = 2 MnO2( t ) + H 2 O + 3 SO 4 2 -
MnO4 - + 4H + + 3 e - = Mn O 2 ( t ) + 2 H 2 O2
DONC 3 2 - +H2O - 2 e - = DONC 4 2 - + 2 H + 3
Formes d'existence d'agents oxydants et d'agents réducteurs avant et après la réaction, c'est-à-dire leurs formes oxydées et réduites sont appelées couples rédox. Ainsi, de la pratique chimique, on sait (et il faut s'en souvenir) que l'ion permanganate dans un environnement acide forme un cation manganèse ( II) (paire MnO 4 - +H+/ Mn 2+ + H 2 O ), dans un environnement légèrement alcalin- oxyde de manganèse(IV) (paire MnO 4 - +H+ ¤ Mn O 2(t) + H 2 O ou MnO 4 - + H 2 O = Mn O2(t) + OH - ). La composition des formes oxydées et réduites est donc déterminée par les propriétés chimiques d'un élément donné dans différents états d'oxydation, c'est-à-dire stabilité inégale de formes spécifiques dans différents environnements de solution aqueuse. Tous les couples rédox utilisés dans cette section sont donnés dans les problèmes 2.15 et 2.16.
Élaboration d'équations pour les réactions redox
Pour écrire l'équation ORR, il faut tout d'abord savoir quelles substances se forment à la suite de la réaction. En général, ce problème peut être résolu expérimentalement. Cependant, la connaissance des caractéristiques chimiques de certains agents oxydants et réducteurs permet souvent de prédire de manière assez fiable (mais pas avec une garantie absolue) la composition des produits d'interaction.
Si les produits de réaction sont connus, les coefficients stoechiométriques dans l’équation de réaction peuvent être trouvés en égalisant le nombre d’électrons gagnés par les atomes oxydants et perdus par les atomes réducteurs. Deux méthodes sont utilisées pour sélectionner les coefficients dans les équations ORR : la méthode de la balance électronique et la méthode de la balance ion-électron. Regardons ces techniques.
La méthode est basée sur le principe de conservation de la charge électrique lors d'une réaction chimique, à la suite de laquelle les substances réagissent dans un rapport qui garantit l'égalité du nombre d'électrons donnés par tous les atomes de l'agent réducteur et attachés par tous les atomes de l'agent réducteur. agent d'oxydation. Pour sélectionner les coefficients, il est conseillé d'utiliser l'algorithme suivant :
1. Notez le schéma ORR (substances de départ et produits de réaction).
2. Identifiez les éléments dont l'état d'oxydation change au cours de la réaction.
3. Élaborer des schémas des processus d'oxydation et de réduction.
4. Trouver des facteurs qui égalisent le nombre d'électrons attachés par les atomes oxydants et perdus par les atomes réducteurs (facteurs d'équilibrage). Pour ce faire, trouvez le plus petit commun multiple des électrons attachés par un atome de l'agent oxydant et donnés par un atome de l'agent réducteur ; les facteurs d'équilibrage seront égaux au plus petit commun multiple divisé par le nombre d'électrons gagnés (pour l'agent oxydant) et d'électrons cédés (pour l'agent réducteur).
5. Déterminez et entrez dans l'équation les coefficients pour les substances contenant des éléments dont l'état d'oxydation change (coefficients de référence) en divisant les facteurs d'équilibrage par le nombre d'atomes oxydants ou réducteurs dans l'unité de formule de la substance. Si le quotient de division n'est pas un nombre entier, les facteurs d'équilibrage doivent être augmentés du nombre de fois requis.
6. Trouver et organiser des coefficients supplémentaires qui égalisent le nombre d'atomes qui n'ont pas changé l'état d'oxydation (à l'exception de l'hydrogène et de l'oxygène) ; De plus, si le milieu est acide, égalisez d'abord les atomes métalliques, puis les anions des acides si le milieu est alcalin ou neutre, vice versa ;
7. Égalisez le nombre d'atomes d'hydrogène, en ajoutant de l'eau à droite ou à gauche de l'équation si nécessaire.
8. Vérifiez si les coefficients pour l'oxygène sont sélectionnés correctement.
Considérons, à titre d'exemple, la compilation de l'équation d'interaction du permanganate de potassium avec le sulfate de fer(II) en milieu sulfate selon les étapes de l'algorithme proposé :
1. KMnO 4 + FeSO 4 + H 2 SO 4 → MnSO 4 + Fe 2 (SO 4) 3 + K 2 SO 4
2. KMn +7 O 4 + Fe +2 SO 4 + H 2 S0 4 → Mn +2 SO 4 + Fe(SO 4) 3 + K 2 SO 4
3. Fe +2 - 1e - = Fe +3 (oxydation)
Mn +7 +5e - = Mn +2 (récupération)
4. Fe +2 - 1e - = Fe +3 │5 │ 10
Mn +7 + 5e - = Mn +2 │1 │2
5. Coefficients de référence : avec KMnO 4 - 2:1=2, avec FeSO 4 - 10:1=10, avec MnSO 4 - 2:1=2, avec Fe 2 (SO 4) 3 - 10:2=5.
2KMnO 4 + 10FeSO 4 + H 2 SO 4 → 2MnSO 4 + 5Fe 2 (SO 4) 3 + K 2 SO 4
6. L’environnement est acide, nous égalisons donc d’abord les atomes de potassium, puis les ions sulfate.
2KMnO 4 + 10FeSO 4 + 5H 2 SO 4 → 2MnSO 4 + 5Fe 2 (SO 4) 3 + K 2 SO 4
7. Puisque le côté gauche de l’équation contient 10 atomes d’hydrogène, nous ajoutons 5 molécules d’eau au côté droit :
2KMnO 4 + 10FeSO 4 + 5H 2 SO 4 = 2MnSO 4 + 5Fe 2 (SO 4) 3 + K 2 SO 4 + 5H 2 O
8. Le nombre d'atomes d'oxygène (sans compter l'oxygène inclus dans les ions sulfate) sur les côtés droit et gauche de l'équation est 8. Les coefficients sont choisis correctement.
Au cours des réactions redox, il peut y avoir des cas où l'agent oxydant ou réducteur est partiellement consommé pour lier les produits d'oxydation ou de réduction sans modifier l'état d'oxydation de l'élément correspondant. Dans ce cas, le coefficient d'une substance à double fonction est égal à la somme des coefficients de référence et supplémentaires et est entré dans l'équation après avoir trouvé le coefficient supplémentaire. Ainsi, la réaction entre le zinc et l'acide nitrique très dilué se déroule selon l'équation
4Zn + 10HNO 3 = 4Zn(NO 3) 2 + NH 4 NO 3 +3H 2 O
Zn 0 - 2e - = Zn +2 │4
N +5 + 8e - = N -3 │1
Comme il ressort des schémas d'oxydo-réduction, une molécule d'acide nitrique est nécessaire pour l'oxydation de quatre atomes de zinc (coefficient de référence pour HNO 3 - 1) ; cependant, la formation de quatre molécules de nitrate de zinc et d'une molécule de nitrate d'ammonium nécessite neuf molécules supplémentaires de HNO 3, qui réagissent sans changer l'état d'oxydation de l'azote (un coefficient supplémentaire pour HNO 3 - 9). En conséquence, le coefficient de l'acide nitrique dans l'équation de réaction sera égal à 10 et 3 molécules d'eau doivent être introduites dans le côté droit de l'équation.
Si l'une des substances fonctionne simultanément comme agent oxydant et réducteur (réaction de dismutation) ou est un produit à la fois d'oxydation et de réduction (réaction de contre-dismutation), alors le coefficient de cette substance est égal à la somme de la référence coefficients pour l'agent oxydant et l'agent réducteur. Par exemple, dans l'équation de la réaction de dismutation du soufre en milieu alcalin, le coefficient du soufre est égal à trois.
3S 0 + 6NaOH = Na 2 S +4 O 3 + Na 2 S -2 + 3H 2 O
S - 4e - = S +4 │1
S + 2e - = S -2 │2
Parfois, lors d'une réaction redox, un changement dans l'état d'oxydation de plus de deux éléments est observé ; dans ce cas, les coefficients de l'équation peuvent être déterminés de manière unique si tous les agents oxydants ou tous les agents réducteurs font partie d'une seule molécule. Dans ce cas, il est rationnel de calculer les électrons donnés ou attachés pour l'unité de formule d'une substance contenant ces agents oxydants ou réducteurs. À titre d'exemple, considérons l'interaction du sulfure d'arsenic (III) avec l'acide nitrique selon les étapes de l'algorithme donné.
1. Comme 2 S 3 + HNO 3 → H 3 AsO 4 + H 2 SO 4 + NON
2. AsS+ HN +5 O 3 → H 3 As +5 O 4 + H 2 S +6 O 4 + N +2 O
La réaction implique deux agents réducteurs (As +3 et S -2) et un agent oxydant (N +5).
3. N +5 + 3e - = N +2 │28
Comme 2 S 3 - 28e - = 2As +5 + 3S +6 │ 3
4. Le plus petit commun multiple est 84, les facteurs d'équilibrage sont 28 et 3.
5. 3As 2 S 3 + 28HNO 3 → 6H 3 AsO 4 + 9H 2 SO 4 + 28NO
6. Il n'y a pas de coefficients supplémentaires.
7. Les molécules d'eau doivent être inscrites dans le côté gauche de l'équation :
3As 2 S 3 + 28HNO 3 + 4H 2 O = 6H 3 AsO 4 + 9H 2 SO 4 + 28NO
8. Le nombre d’atomes d’oxygène à gauche et à droite de l’équation est de 88. Les coefficients sont choisis correctement.
Si des substances organiques sont impliquées dans l'ORR, alors leur état d'oxydation n'est pas déterminé, car dans ce cas, chaque atome peut avoir sa propre valeur d'état d'oxydation, et souvent pas une valeur entière. Lors de l'élaboration de schémas d'oxydo-réduction pour de telles réactions, les règles suivantes doivent être respectées :
1. l’ajout d’un atome d’oxygène est identique à la perte de deux électrons par la molécule ;
2. la perte d'un atome d'oxygène est identique à l'addition de deux électrons ;
3. l'ajout d'un atome d'hydrogène est identique à l'ajout d'un électron ;
4. La perte d’un atome d’hydrogène est identique à la perte d’un électron.
Ci-dessous, à titre d'exemple, l'équation d'oxydation de l'alcool éthylique avec du bichromate de potassium :
3C 2 H 5 OH + 2K 2 Cr 2 O 7 + 8H 2 SO 4 = 3CH 3 COOH + 2Cr 2 (SO 4) 3 + 2K 2 SO 4 + 11H 2 O
C 2 H 5 OH + [O] - 2[H] - 4e - = 3CH 3 COOH │3
Cr +6 + 3e - = Cr +3 │4
La conversion de l'alcool éthylique en acide acétique nécessite l'ajout d'un atome d'oxygène et la perte de deux atomes d'hydrogène, ce qui correspond à la perte de quatre électrons.
La méthode de la balance électronique est une méthode universelle applicable à tout ORR se produisant dans la phase gazeuse, les systèmes condensés et les solutions. L'inconvénient de la méthode est que cette technique est formelle et fonctionne avec des particules qui n'existent pas réellement (Mn +7, N +5, etc.).




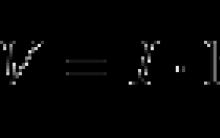






Contrôle contre signature : comment s'inscrire ?
Étapes de construction et conditions d'élaboration de la politique du personnel Conditions d'élaboration de la politique du personnel
Chuk et Gek lisent l'intégralité avec des illustrations
Journée des Héros de la Patrie, présentation pour un cours (7e année) sur le thème Présentation des Héros de la Patrie pour l'école primaire
Théories de la stratification sociale