A. H2S B.SO3 C.H2SO3
2. Anglies oksidacijos laipsnis kalcio karbonate yra:
A. -4 B.+2 C.+4
3. Medžiaga, kurios fosforo oksidacijos laipsnis lygus nuliui:
A. P4 B.PH3 C.P2O5
4. Redoksas yra reakcija, kurios lygtis:
A.2Al(OH)3=Al2O3+3H2O B.H2+Cl2=2HCl C.NaOH+HNO3=NaNO3+H2O
5. Oksidatorius cheminėje reakcijoje CuO+H2=Cu+H2O yra:
A.H20 B.Cu2+ C.O2- D.Cu0
6. Chloro oksidacijos laipsnis mažėja serijoje:
A.Cl2– HCl–HClO B.NaCl–Cl2–KClO3 C.HClO4–NaClO2–BaCl2
7. Perėjimo procesas, kurio schema N-3→N+2 yra:
A. Atsigavimas
B. Oksidacija
B. Ne redokso procesas.
8. Reakcijos lygtyje S + O2 → SO2 oksidatoriaus atiduotų elektronų skaičius yra:
A.2 B.4 C.6
9. Fosforas, kurio oksidacijos būsena 0, gali būti:
A.Tik reduktorius
B. Tik oksidatorius
B. Oksidatorius ir reduktorius
10. Paprasta medžiaga yra nemetalas, pasižymintis stipriausiomis oksidacinėmis savybėmis:
A. Br2
B. Cl2
B. F2
B dalis.
11. Parašykite azoto oksido (III) ir azoto oksido (V) formules.
12. Reakcijos schemoje elektroninio balanso metodu išdėliokite koeficientus:
Ca + O2 = CaO
Įvardykite oksidacijos ir redukcijos procesus, nurodykite oksidatorių ir reduktorius.
13. Išdėstykite cheminių junginių formules: CH4, CO2, CO - anglies atomų oksidacijos laipsnio mažėjimo tvarka.
14. Pagal schemą Cu + 2 + 2ē → Cu0 sudarykite cheminės reakcijos lygtį ir apsvarstykite ją OVR požiūriu.
15. Užbaikite frazę: „Restauravimas yra...“
nustatyti kiekvieno elemento oksidacijos laipsnį, elektroninio balanso metodu sutvarkyti koeficientus: KCIO3 + S -> KCI + SO2. 3) Prašome nustatyti sieros oksidacijos laipsnį šiuose junginiuose: H2SO4, SO2, H2S, SO2, H2SO3. 4 link kurio cheminio elemento atomų bendrosios elektronų poros pasislenka šių junginių molekulėse: H2O, HI, PCI3, H3N, H2S, CO2? prašau pateikti teisingą atsakymą! 5) pasakykite, ar pasikeičia atomų oksidacijos būsenos, kai vanduo susidaro iš vandenilio ir deguonies? 6) parašykite elektrolitinės disociacijos lygtis: vario nitratas, vandenilio chlorido rūgštis s, aliuminio sulfatas, bario hidroksidas, cinko sulfatas. 7) Parašykite molekulines ir jonines reakcijų lygtis tarp tirpalų: ličio hidroksido ir azoto rūgšties, vario nitrato ir natrio hidroksido, kalio karbonato ir fosforo rūgšties. 8) kurių medžiagų tirpalams sąveikaujant vienas iš reakcijos produktų yra vanduo? K2CO3 ir HCI: Ca(OH)2 ir HNO3: NaOH ir H2SO4: NaNO3 ir H2SO4? Reakcijų lygtis surašykite molekulinėmis ir joninėmis formulėmis. 9) kurios iš šių druskų hidrolizuojasi ištirpusios vandenyje: aliuminio chloridas, kalio sulfidas, natrio chloridas? Parašykite hidrolizės lygtis.
Įprastomis sąlygomis azoto rūgštis yra bespalvis skystis (tankis 1,52 g/cm 3 ), verdantis 82,6 o C temperatūroje, o temperatūroje (-41,6 o C) kietėjantis į skaidrią kristalinę masę. Bendroji formulė – HNO 3 . Molinė masė - 93 g/mol. Azoto rūgšties molekulės struktūra parodyta fig. vienas.
Azoto rūgštis bet kokiu santykiu maišosi su vandeniu. Tai stiprus elektrolitas, t.y. vandeniniame tirpale beveik visiškai disocijuoja į jonus. OVR jis veikia kaip oksidatorius.
Ryžiai. 1. Azoto rūgšties molekulės struktūra, nurodanti ryšių kampus tarp jungčių ir cheminių jungčių ilgius.
HNO3, jame esančių elementų oksidacijos būsenos
Norėdami nustatyti azoto rūgštį sudarančių elementų oksidacijos būsenas, pirmiausia turite išsiaiškinti, kuriems elementams ši vertė tiksliai žinoma.
Vandenilio ir deguonies oksidacijos būsenos neorganinių rūgščių sudėtyje visada yra lygios (+1) ir (-2). Norėdami sužinoti azoto oksidacijos būseną, paimkime jo reikšmę „x“ ir nustatykime ją naudodami elektroneutralumo lygtį:
(+1) + x + 3 × (-2) = 0;
1 + x - 6 = 0;
Taigi azoto oksidacijos laipsnis azoto rūgštyje yra (+5):
H +1 N +5 O -2 3 .
Problemų sprendimo pavyzdžiai
1 PAVYZDYS
Junginiai, kurių oksidacijos laipsnis –3.-3 oksidacijos būsenos azoto junginius vaizduoja amoniakas ir metalų nitridai.
Amoniakas- NH 3 yra bespalvės dujos, turinčios būdingą aštrų kvapą. Amoniako molekulė turi trikampės piramidės geometriją, kurios viršuje yra azoto atomas. Azoto atominės orbitalės yra sp 3- hibridinė būsena. Formuojant azoto-vandenilio ryšius dalyvauja trys orbitalės, o ketvirtoje orbitalėse yra nepasidalinta elektronų pora, molekulė turi piramidės formą. Vienišų elektronų poros atstumiantis veiksmas lemia, kad ryšio kampas sumažėja nuo tikėtino 109,5 iki 107,3°.
Esant -33,4 °C temperatūrai amoniakas kondensuojasi ir susidaro skystis su labai aukšta garavimo šiluma, todėl jį galima naudoti kaip šaltnešį pramoninėse šaldymo sistemose.
Nepaskirstytos elektronų poros buvimas prie azoto atomo leidžia sudaryti kitą kovalentinį ryšį pagal donoro-akceptoriaus mechanizmą. Taigi rūgščioje aplinkoje susidaro molekulinis amonio katijonas - NH 4 +. Dėl tolygaus vandenilio atomų atstūmimo, susidarius ketvirtajam kovalentiniam ryšiui, jungties kampai išsilygina (109,5°).

Skystas amoniakas yra geras savaime jonizuojantis tirpiklis:
2NH 3 NH 4 + + NH 2 -
amido anijonas
Jame ištirpsta šarminiai ir šarminių žemių metalai, sudarydami spalvotus laidžius tirpalus. Esant katalizatoriui (FeCl 3), ištirpęs metalas reaguoja su amoniaku, kad išsiskirtų vandenilis ir susidarytų amidas, pavyzdžiui:
2Na + 2NH3 \u003d 2NaNH2 + H2
natrio amidas
Amoniakas labai gerai tirpsta vandenyje (esant 20 °C, viename tūryje vandens ištirpsta apie 700 tūrių amoniako). Vandeniniuose tirpaluose jis pasižymi silpnos bazės savybėmis.
NH 3 + H 2 O ® NH 3 × H 2 O NH 4 + + OH -
 = 1,85 10 -5
= 1,85 10 -5
Deguonies atmosferoje amoniakas dega susidarant azotui; platinos katalizatoriuje amoniakas oksiduojamas iki azoto oksido (II):
4NH3 + 3O2 = 2N2 + 6H2O; 4NH3 + 5O 2 \u003d 4NO + 6H 2 O
Kaip bazė, amoniakas reaguoja su rūgštimis, sudarydamas amonio katijono druskas, pavyzdžiui:
NH 3 + HCl = NH 4 Cl
Amonio druskos gerai tirpsta vandenyje ir šiek tiek hidrolizuotos. Kristalinėje būsenoje jie yra termiškai nestabilūs. Termolizės produktų sudėtis priklauso nuo rūgšties, sudarančios druską, savybių:
NH 4 Cl ® NH 3 + HCl; (NH 4) 2 SO 4 ® NH 3 + (NH 4) HSO 4
(NH 4) 2 Cr 2 O 7 ® N 2 + Cr 2 O 3 + 4H 2 O
Šarmams veikiant vandeninius amonio druskų tirpalus, kaitinant išsiskiria amoniakas, todėl šią reakciją galima panaudoti kaip kokybinę amonio druskų reakciją ir kaip laboratorinį amoniako gavimo būdą.
NH 4 Cl + NaOH \u003d NaCl + NH 3 + H 2 O
Pramonėje amoniakas gaunamas tiesioginės sintezės būdu.
N2 + 3H22NH3
Kadangi reakcija yra labai grįžtama, sintezė vykdoma esant padidintam slėgiui (iki 100 MPa). Siekiant pagreitinti procesą, procesas vykdomas esant katalizatoriui (kempinė geležis, skatinama priedų) ir maždaug 500°C temperatūroje.
Nitridas susidaro daugelio metalų ir nemetalų reakcijos su azotu rezultatas. Nitridų savybės natūraliai keičiasi tam tikru laikotarpiu. Pavyzdžiui, trečiojo laikotarpio elementams:
I ir II grupių s elementų nitridai yra į kristalines druskas panašios medžiagos, kurias vanduo lengvai skaido ir susidaro amoniakas.
Li 3 N + 3H 2 O \u003d 3LiOH + NH3
Iš laisvos būsenos halogeninių nitridų buvo išskirtas tik Cl 3 N, rūgštingumas pasireiškia reakcijoje su vandeniu:
Cl 3 N + 3H 2 O \u003d 3HClO + NH 3
Dėl skirtingo pobūdžio nitridų sąveikos susidaro mišrūs nitridai:
Li 3 N + AlN \u003d Li 3 AlN 2; 5Li 3 N + Ge 3 N 4 = 3 Li 5 Gen 3
ličio nitridoaliuminatas nitridogermanatas(IV) litis
BN, AlN, Si 3 N 4, Ge 3 N 4 nitridai yra kietos polimerinės medžiagos, turinčios aukštą lydymosi temperatūrą (2000-3000 °C), tai puslaidininkiai arba dielektrikai. D-metalų nitridai – kintamos sudėties kristaliniai junginiai (bertolidai), labai kieti, atsparūs ugniai ir chemiškai stabilūs, pasižymi metalinėmis savybėmis: metaliniu blizgesiu, laidumu elektrai.
Junginiai, kurių oksidacijos laipsnis –2. Hidrazinas - N 2 H 4 - svarbiausias neorganinis azoto junginys, esantis -2 oksidacijos būsenai.
Hidrazinas yra bespalvis skystis, kurio virimo temperatūra yra 113,5 °C, rūkantis ore. Hidrazino garai yra labai toksiški ir sudaro sprogius mišinius su oru. Hidrazinas gaunamas oksiduojant amoniaką natrio hipochloritu:
2N -3 H3 + NaCl +1 O \u003d N 2 -2 H4 + NaCl -1 + H 2 O
Hidrazinas bet kokiu santykiu maišosi su vandeniu ir tirpale elgiasi kaip silpna dirūgštinė bazė, sudarydama dvi druskų serijas.
N 2 H 4 + H 2 O N 2 H 5 + + OH - , K b = 9,3 × 10 -7;
hidrosonio katijonas
N 2 H 5 + + H 2 O N 2 H 6 2+ + OH - , K b = 8,5 × 10 -15;
dihidrozonio katijonas
N 2 H 4 + HCl N 2 H 5 Cl; N 2 H 5 Cl + HCl N 2 H 6 Cl 2
hidrosonio chloridas dihidrozonio dichloridas
Hidrazinas yra stipriausias reduktorius:
4KMn + 7 O 4 + 5N 2 -2 H 4 + 6H 2 SO 4 \u003d 5N 2 0 + 4 Mn + 2 SO 4 + 2K 2 SO 4 + 16H 2 O
Nesimetriškas dimetilhidrazinas (heptilas) plačiai naudojamas kaip raketų kuras.
Junginiai, kurių oksidacijos laipsnis –1. Hidroksilaminas - NH 2 OH - pagrindinis neorganinis azoto junginys, esantis -1 oksidacijos būsenai.
Hidroksilaminas gaunamas redukuojant azoto rūgštį vandeniliu izoliacijos metu elektrolizės metu:
HNO 3 + 6H \u003d NH 2OH + 2H 2 O
Tai bespalvė kristalinė medžiaga (temp. 33 °C), labai gerai tirpi vandenyje, kurioje ji pasižymi silpnos bazės savybėmis. Su rūgštimis duoda hidroksilammonio druskų – stabilių, bespalvių medžiagų, tirpsta vandenyje.
NH 2 OH + H 2 O + + OH - , K b = 2 × 10 -8
hidroksilamonio jonai
Azoto atomas NH 2 OH molekulėje turi tarpinę oksidacijos būseną (tarp -3 ir +5), todėl hidroksilaminas gali veikti ir kaip reduktorius, ir kaip oksidatorius:
2N -1 H2OH + I2 + 2KOH = N 0 2 + 2KI + 4H 2 O;
reduktorius
2N -1 H2OH + 4FeSO 4 + 3H 2 SO 4 = 2Fe 2 (SO 4) 3 + (N -3 H 4) 2 SO 4 + 2H 2 O
oksidatorius
NH 2 OH lengvai suyra kaitinant, patiriamas neproporcingumas:
3N -1 H2OH \u003d N 0 2 + N -3 H3 + 3H 2 O;
Junginiai, kurių oksidacijos laipsnis +1. Azoto oksidas (I) - N 2 O (azoto oksidas, juoko dujos). Jo molekulės struktūrą galima perteikti dviejų valentinių schemų rezonansu, iš kurių matyti, kad šį junginį azoto oksidu (I) galima laikyti tik formaliai, realiai tai yra azoto (V) oksinitridas - ON +5 N -3.
![]()
N 2 O yra bespalvės dujos, turinčios lengvą malonų kvapą. Mažomis koncentracijomis sukelia nežaboto džiaugsmo priepuolius, didelėmis dozėmis turi bendrą anestezinį poveikį. Medicinoje anestezijai buvo naudojamas azoto oksido (80%) ir deguonies (20%) mišinys.
Laboratorinėmis sąlygomis azoto oksidas (I) gali būti gaunamas skaidant amonio salietrą. Šiuo metodu gautame N 2 O yra aukštesniųjų azoto oksidų priemaišų, kurios yra itin toksiškos!
NH 4 NO 3 ¾® N 2 O + 2H 2 O
Autorius cheminės savybės azoto oksidas (I) yra tipiškas druskos nesudarantis oksidas, nereaguoja su vandeniu, rūgštimis ir šarmais. Kaitinamas, jis suyra, sudarydamas deguonį ir azotą. Dėl šios priežasties N 2 O gali veikti kaip oksidatorius, pavyzdžiui:
N 2 O + H 2 \u003d N 2 + H 2 O
Junginiai, kurių oksidacijos laipsnis +2. Azoto oksidas (II) – NO – bespalvės dujos, itin toksiškos. Ore jis greitai oksiduojamas deguonies ir susidaro ne mažiau toksiškas azoto oksidas (IV). Pramonėje NO susidaro oksiduojant amoniaką ant platinos katalizatoriaus arba leidžiant orą elektros lanku (3000-4000 °C).
4NH3 + 5O2 \u003d 4NO + 6H2O; N 2 + O 2 \u003d 2NO
Laboratorinis azoto oksido (II) gavimo metodas yra vario sąveika su praskiesta azoto rūgštimi.
3Cu + 8HNO3 (diff.) = 3Cu(NO 3) 2 + 2NO + 4H 2 O
Azoto oksidas (II) yra druskos nesudarantis oksidas, stiprus reduktorius, lengvai reaguoja su deguonimi ir halogenais.
2NO + O 2 \u003d 2NO 2; 2NO + Cl 2 = 2NOCl
nitrozilo chloridas
Tuo pačiu metu, sąveikaudamas su stipriais reduktoriais, NO veikia kaip oksidatorius:
2NO + 2H2 = N2 + 2H2O; 10NO + 4Р = 5N 2 + 2Р 2 O 5
Junginiai, kurių oksidacijos laipsnis +3. Azoto oksidas (III) - N 2 O 3 - intensyviai mėlynas skystis (t.kr. -100 °C). Stabilus tik skystoje ir kietoje būsenoje esant žemai temperatūrai. Atrodo, kad jis egzistuoja dviem formomis:
Azoto oksidas (III) gaunamas kartu kondensuojant NO ir NO 2 garus. Disocijuoja skysčiuose ir garuose.
NO 2 + NO N 2 O 3
Tipiškos savybės rūgšties oksidas. Reaguoja su vandeniu, susidaro azoto rūgštis, su šarmais susidaro druskos – nitritai.
N 2 O 3 + H 2 O \u003d 2HNO 2; N 2 O 3 + 2NaOH \u003d 2NaNO 2 + H 2 O
Azoto rūgštis- vidutinio stiprumo rūgštis (K a = 1×10 -4). Jis nebuvo išskirtas gryna forma, tirpaluose jis egzistuoja dviem tautomerinėmis formomis (tautomerai yra izomerai, esantys dinaminėje pusiausvyroje).

nitrito forma nitro forma
Azoto rūgšties druskos yra stabilios. Nitrito anijonas turi ryškų redokso dvilypumą. Priklausomai nuo sąlygų, jis gali atlikti ir oksidatoriaus, ir redukcijos agento funkciją, pavyzdžiui:
2NaNO 2 + 2KI + 2H 2 SO 4 = I 2 + 2NO + K 2 SO 4 + Na 2 SO 4 + 2H 2 O
oksidatorius
KMnO4 + 5NaNO2 + 3H2SO4 = 2MnSO4 + 5NaNO3 + K2SO4 + 3H2O
reduktorius
Azoto rūgštis ir nitritai yra linkę į disproporciją:
3HN +3 O 2 \u003d HN +5 O 3 + 2N +2 O + H 2 O
Junginiai, kurių oksidacijos laipsnis +4. Azoto oksidas (IV) – NO 2 – rudos dujos, turinčios aštrų nemalonų kvapą. Itin toksiška! Pramonėje NO 2 susidaro oksiduojant NO. Laboratorinis NO 2 gavimo būdas – vario sąveika su koncentruota azoto rūgštimi, taip pat terminis švino nitrato skaidymas.
Cu + 4HNO3 (konc.) = Cu(NO 3) 2 + 2NO 2 + 2H 2 O;
2Pb(NO 3) 2 \u003d 2PbO + 4NO 2 + O 2
NO 2 molekulė turi vieną nesuporuotą elektroną ir yra stabilus laisvasis radikalas, todėl azoto oksidas lengvai dimerizuojasi.

Dimerizacijos procesas yra grįžtamasis ir labai jautrus temperatūrai:
paramagnetinis, diamagnetinis,
ruda bespalvė
Azoto dioksidas yra rūgštus oksidas, kuris reaguoja su vandeniu ir sudaro azoto ir azoto rūgšties mišinį (mišrus anhidridas).
2NO 2 + H 2 O \u003d HNO 2 + HNO 3; 2NO 2 + 2NaOH \u003d NaNO 3 + NaNO 2 + H 2 O
Junginiai, kurių oksidacijos laipsnis +5. Azoto oksidas (V) - N 2 O 5 - balta kristalinė medžiaga. Gaunamas dehidratuojant azoto rūgštį arba oksiduojant azoto oksidą (IV) ozonu:
2HNO 3 + P 2 O 5 \u003d N 2 O 5 + 2HPO 3; 2NO 2 + O 3 \u003d N 2 O 5 + O 2
Kristalinėje būsenoje N 2 O 5 turi panašią į druską struktūrą - + -, garuose (t. vozg. 33 ° C) - molekulinę.

N 2 O 5 - rūgšties oksidas - azoto rūgšties anhidridas:
N 2 O 5 + H 2 O \u003d 2HNO 3
Azoto rūgštis- HNO 3 - bespalvis skystis, kurio virimo temperatūra yra 84,1 ° C, suyra kaitinant ir šviesoje.
4HNO 3 \u003d 4NO 2 + O 2 + 2H 2 O
Azoto dioksido priemaišos suteikia koncentruotai azoto rūgščiai geltonai rudą spalvą. Azoto rūgštis bet kokiu santykiu maišosi su vandeniu ir yra viena stipriausių mineralinių rūgščių, tirpale ji visiškai disocijuoja.
Azoto rūgšties molekulės struktūra apibūdinama šiomis struktūrinėmis formulėmis:

Sunkumų rašant HNO 3 struktūrinę formulę sukelia tai, kad, rodant šiame junginyje oksidacijos būseną +5, azotas, kaip antrojo periodo elementas, gali sudaryti tik keturis kovalentinius ryšius.
Azoto rūgštis yra viena stipriausių oksidatorių. Jo atsigavimo gylis priklauso nuo daugelio veiksnių: koncentracijos, temperatūros, redukuojančios medžiagos. Paprastai, oksiduojant azoto rūgštimi, susidaro redukcijos produktų mišinys:
HN +5 O 3 ® N +4 O 2 ® N +2 O ® N +1 2 O ® N 0 2 ® +
Dominuojantis nemetalų ir neaktyvių metalų oksidacijos koncentruota azoto rūgštimi produktas yra azoto oksidas (IV):
I2 + 10HNO3 (konc.) = 2HIO3 + 10NO2 + 4H2O;
Pb + 4HNO 3 (konc.) = Pb (NO 3) 2 + 2NO 2 + 2H 2 O
Koncentruota azoto rūgštis pasyvina geležį ir aliuminį. Aliuminis pasyvinamas net praskiesta azoto rūgštimi. Bet kokios koncentracijos azoto rūgštis neturi įtakos auksui, platinai, tantalui, rodžiui ir iridžiui. Auksas ir platina ištirpinami aqua regia – koncentruotų azoto ir druskos rūgščių mišinyje santykiu 1:3.
Au + HNO 3 + 4HCl \u003d H + NO + 2H 2 O
Stiprų oksidacinį vandens regijos poveikį lemia atominio chloro susidarymas nitrozilo chlorido, azoto rūgšties ir vandenilio chlorido sąveikos produkto, skilimo metu.
HNO 3 + 3HCl \u003d Cl 2 + NOCl + 2H 2 O;
NOCl = NO + Cl×
Veiksmingas mažo aktyvumo metalų tirpiklis yra koncentruotų azoto ir vandenilio fluorido rūgščių mišinys.
3Ta + 5HNO3 + 21HF = 3H2 + 5NO + 10H 2O
Praskiesta azoto rūgštis, sąveikaudama su nemetalais ir mažai aktyviais metalais, daugiausia redukuojama iki azoto oksido (II), pavyzdžiui:
3P + 5HNO3 (razb) + 2H 2O \u003d 3H3PO4 + 5NO;
3Pb + 8HNO 3 (razb) \u003d 3Pb (NO 3) 2 + 2NO + 4H 2 O
Pavyzdžiui, aktyvūs metalai sumažina praskiestą azoto rūgštį iki N 2 O, N 2 arba NH 4 NO 3,
4Zn + 10HNO 3 (razb) \u003d 4Zn (NO 3) 2 + NH 4 NO 3 + 3H 2 O
Didžioji dalis azoto rūgšties atitenka trąšų gamybai ir sprogmenų.
Azoto rūgštis pramoniniu būdu gaminama kontaktiniu arba lankiniu būdu, kurie skiriasi pirmuoju etapu – azoto oksido (II) gamyba. Lanko metodas pagrįstas NO gamyba praleidžiant orą elektros lanku. Kontaktinio proceso metu NO susidaro oksiduojant amoniaką deguonimi virš platinos katalizatoriaus. Tada azoto oksidas (II) atmosferos deguonimi oksiduojamas į azoto oksidą (IV). Tirpinant NO 2 vandenyje esant deguoniui, gaunama 60-65 % koncentracijos azoto rūgštis.
4NO 2 + O 2 + 2H 2 O \u003d 4HNO 3
Jei reikia, azoto rūgštis koncentruojama distiliuojant su koncentruota sieros rūgštimi. Laboratorijoje 100 % azoto rūgšties galima gauti koncentruota sieros rūgštimi veikiant kristalinį natrio nitratą kaitinant.
NaNO 3 (kr) + H 2 SO 4 (konc.) = HNO 3 + NaHSO 4
Azoto rūgšties druskos- nitratai - gerai tirpsta vandenyje, termiškai nestabilus. Skildami aktyvių metalų (išskyrus ličio) nitratus, kurie yra standartinių elektrodo potencialų serijoje magnio kairėje, susidaro nitritai. Pavyzdžiui:
2KNO 3 = 2KNO 2 + O 2
Skilimo metu ličio ir magnio nitratams, taip pat metalų nitratams, esantiems standartinių elektrodų potencialų serijoje magnio dešinėje iki vario, išsiskiria azoto oksido (IV) ir deguonies mišinys. Pavyzdžiui:
2Cu(NO 3) 2 \u003d 2CuO + 4NO 2 + O 2
Metalų nitratai, esantys veiklos serijos pabaigoje, skyla į laisvą metalą:
2AgNO 3 \u003d 2Ag + 2NO 2 + O 2
Natrio, kalio ir amonio nitratai plačiai naudojami parako ir sprogstamųjų medžiagų, taip pat azoto trąšų (druskos) gamybai. Amonio sulfatas, amoniako vanduo ir karbamidas (karbamidas) – pilnas anglies rūgšties amidas taip pat naudojami kaip trąšos:
Vandenilio azidas(dinitridonitratas) - HN 3 (HNN 2) - bespalvis lakus skystis (mp -80 ° C, vir. 37 ° C), turintis aštrų kvapą. Centrinis azoto atomas yra sp hibridizacijoje, oksidacijos laipsnis yra +5, šalia esančių atomų oksidacijos būsena –3. Molekulių struktūra:

Vandeninis HN 3 - azoto rūgšties tirpalas yra artimas acto rūgščiai, K a = 2,6 × 10 -5. Stabilus praskiestuose tirpaluose. Jis gaunamas sąveikaujant hidrazinui ir azoto rūgštims:
N 2 H 4 + HNO 2 \u003d HN 3 + 2H 2 O
Oksidacinėmis savybėmis HN 3 (HN +5 N 2) primena azoto rūgštį. Taigi, jei metalui sąveikaujant su azoto rūgštimi susidaro azoto oksidas (II) ir vanduo, tada su hidrazoine rūgštimi - azotas ir amoniakas. Pavyzdžiui,
Cu + 3HN +5 N 2 = Cu(N 3) 2 + N 2 0 + NH 3
HN 3 ir HCl mišinys elgiasi kaip Aqua Regia. Vandenilio azoto rūgšties druskos – azidai. Tik azidai yra gana stabilūs šarminių metalų, esant > 300 °C temperatūrai, jie sunaikinami nesprogdami. Likusi dalis suyra sprogus nuo smūgio arba įkaitus. Švino azidas naudojamas detonatorių gamyboje:
Pb(N 3) 2 = Pb + 3N 2 0
Pradinis azidų gamybos produktas yra NaN 3, susidarantis natrio amido ir azoto oksido (I) reakcijos metu:
NaNH 2 + N 2 O \u003d NaN 3 + H 2 O
4.2 Fosforas
Fosforą gamtoje sudaro vienas izotopas - 31 P, fosforo klarkas yra 0,05 mol.%. Jis atsiranda fosfatų mineralų pavidalu: Ca 3 (PO 4) 2 - fosforitas, Ca 5 (PO 4) 3 X (X \u003d F, Cl, OH) - apatitai. Tai yra gyvūnų ir žmonių kaulų ir dantų dalis, taip pat nukleorūgščių (DNR ir RNR) ir adenozino fosforo rūgščių (ATP, ADP ir AMP) sudėtis.
Fosforas gaunamas redukuojant fosforitą koksu, esant silicio dioksidui.
Ca 3 (PO 4) 2 + 3SiO 2 + 5C = 3CaSiO 3 + 2P + 5CO
Paprasta medžiaga – fosforas – sudaro keletą alotropinių modifikacijų, iš kurių pagrindinės yra baltasis, raudonasis ir juodasis fosforas. Baltasis fosforas susidaro kondensuojantis fosforo garams ir yra į baltą vašką panaši medžiaga (mp 44 °C), netirpi vandenyje, tirpi kai kuriuose organiniuose tirpikliuose. Baltasis fosforas turi molekulinę struktūrą ir susideda iš tetraedrinių molekulių P 4 .

Ryšio stiprumas (valencija P-P-P kampas yra tik 60 °) sukelia didelį baltojo fosforo reaktyvumą ir toksiškumą (mirtina dozė yra apie 0,1 g). Kadangi baltasis fosforas labai gerai tirpsta riebaluose, pienas negali būti naudojamas kaip priešnuodis apsinuodijus. Ore baltas fosforas savaime užsiliepsnoja, todėl laikomas hermetiškai uždarytoje cheminių medžiagų inde po vandens sluoksniu.
Raudonasis fosforas turi polimerinę struktūrą. Jis gaunamas kaitinant baltąjį fosforą arba apšvitinant jį šviesa. Skirtingai nuo baltojo fosforo, jis yra šiek tiek reaktyvus ir netoksiškas. Tačiau baltojo fosforo likučiai gali padaryti raudonąjį fosforą toksišką!
Juodasis fosforas gaunamas kaitinant baltąjį fosforą esant 120 tūkst. atm slėgiui. Jis turi polimerinę struktūrą, turi puslaidininkių savybių, yra chemiškai stabilus ir netoksiškas.
Cheminės savybės. Baltasis fosforas spontaniškai oksiduojasi atmosferos deguonimi kambario temperatūroje (kaitinant įvyksta raudonojo ir juodojo fosforo oksidacija). Reakcija vyksta dviem etapais ir ją lydi liuminescencija (chemiliuminescencija).
2P + 3O 2 \u003d 2P 2 O 3; P 2 O 3 + O 2 \u003d P 2 O 5
Fosforas taip pat laipsniškai reaguoja su siera ir halogenais.
2P + 3Cl 2 \u003d 2PCl 3; PCl 3 + Cl 2 = PCl 5
Sąveikaujant su aktyviais metalais, fosforas veikia kaip oksidatorius, sudarydamas fosfidus – fosforo junginius, kurių oksidacijos būsena -3.
3Ca + 2P = Ca 3P 2
Oksiduojančios rūgštys (azoto ir koncentruotos sieros rūgštys) oksiduoja fosforą į fosforo rūgštį.
P + 5HNO 3 (konc.) = H 3 PO 4 + 5NO 2 + H 2 O
Verdant su šarminiais tirpalais, baltas fosforas neproporcingas:
4P 0 + 3KOH + 3H 2 O = P -3 H3 + 3KH 2 P +1 O 2
fosfino kalio hipofosfitas









Kokybės reikalavimai
Durpių ištekliai Frezų durpių gavyba
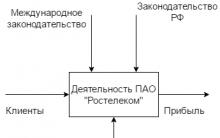
Uždaroji akcinė bendrovė „Transtelecom“.
„Wi-Fi“ įrangos nustatymas
Pasterizavimo stalčius „galvų“ atrinkimui rektifikacijos metu