Les gens du cuivre métallique solide ont appris à fondre avant même notre ère. Le nom de l'élément selon le tableau périodique est Cuprum, en l'honneur de la première production de masse de cuivre. C'était sur l'île de Chypre au troisième millénaire avant notre ère. le minerai a commencé à être extrait. Le métal s'est avéré être une bonne arme et belle, matériau brillant pour la fabrication de vaisselle et autres appareils électroménagers.
processus de fusion du cuivre
La fabrication d'articles demandait beaucoup d'efforts en l'absence de technologie. Dans les premières étapes du développement de la civilisation et de la recherche de nouveaux métaux, les gens ont appris à extraire et à fondre le minerai de cuivre. Le minerai a été obtenu à l'état de malachite, et non à l'état de sulfure. L'obtention de cuivre libre en sortie, à partir duquel des pièces peuvent être réalisées, nécessite une cuisson. Pour exclure les oxydes, le métal avec du charbon de bois a été placé dans un récipient en argile. Le métal a été incendié dans une fosse spécialement préparée, le monoxyde de carbone formé au cours du processus a contribué au processus d'apparition du cuivre libre.
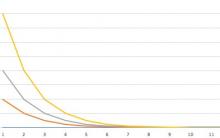
Pour des calculs précis, le graphique de fusion du cuivre a été utilisé. À cette époque, un calcul précis du temps et de la température approximative à laquelle le cuivre est fondu a été effectué.
Cuivre et ses alliages
Le métal a une teinte jaune rougeâtre due à film d'oxyde, qui se forme lors de la première interaction du métal avec l'oxygène. Le film donne un aspect noble et possède des propriétés anti-corrosion.
Maintenant, il existe plusieurs façons d'extraire le métal. Les pyrites et les paillettes de cuivre sont courantes, qui se présentent sous forme de minerais sulfurés. Chacune des technologies d'obtention du cuivre nécessite une approche particulière et un suivi du processus.
L'exploitation minière dans des conditions naturelles se fait sous la forme d'une recherche d'ardoises et de pépites de cuivre. Des dépôts volumétriques sous forme de roches sédimentaires sont situés au Chili, et des grès et schistes de cuivre sont situés sur le territoire du Kazakhstan. L'utilisation de métal est due au bas point de fusion. Presque tous les métaux fondent en détruisant le réseau cristallin.
Ordre de fusion de base et propriétés :
- à des seuils de température de 20 à 100°, le matériau conserve totalement ses propriétés et apparence, la couche d'oxyde supérieure reste en place ;
- le réseau cristallin se brise à environ 1082°, l'état physique devient liquide et la couleur est blanche. Le niveau de température s'attarde pendant un certain temps, puis continue d'augmenter;
- le point d'ébullition du cuivre commence vers 2595°, du carbone est libéré, un bouillonnement caractéristique se produit ;
- lorsque la source de chaleur est éteinte, la température diminue et le passage au stade solide a lieu.
La fonte du cuivre est possible à domicile, sous certaines conditions. Les étapes et la complexité de la tâche dépendent du choix des équipements.
Propriétés physiques
Les principales caractéristiques du métal:
- sous sa forme pure, la masse volumique du métal est de 8,93 g/cm3 ;
- bonne conductivité électrique avec un indicateur de 55.5S, à une température d'environ 20⁰ ;
- transfert de chaleur 390 J/kg ;
- l'ébullition se produit vers 2600 °, après quoi la libération de carbone commence;
- résistivité électrique dans la plage de température moyenne - 1,78 × 10 Ohm/m.
Les principaux domaines d'exploitation du cuivre sont à des fins électriques. Le transfert de chaleur élevé et la ductilité le rendent adapté à diverses applications. Les alliages de cuivre avec le nickel, le laiton, le bronze, rendent le coût plus acceptable et améliorent les performances.
Dans la nature, sa composition n'est pas homogène, car elle contient un certain nombre d'éléments cristallins qui forment avec lui une structure stable, les soi-disant solutions, qui peuvent être divisées en trois groupes:
- solutions solides. Ils se forment si la composition contient des impuretés de fer, de zinc, d'antimoine, d'étain, de nickel et de nombreuses autres substances. De tels événements réduisent considérablement sa conductivité électrique et thermique. Ils compliquent le traitement sous pression de type chaud.
- Impuretés se dissolvant dans un réseau de cuivre. Ceux-ci incluent le bismuth, le plomb et d'autres composants. Ils n'altèrent pas la qualité de la conductivité électrique, mais la rendent difficile à traiter sous pression.
- Impuretés qui forment des composés chimiques fragiles. Cela comprend l'oxygène et le soufre, ainsi que d'autres éléments. Ils détériorent les qualités de résistance, notamment en réduisant la conductivité électrique.
La masse de cuivre avec des impuretés est beaucoup plus grande que sous sa forme pure. De plus, les éléments d'impuretés affectent significativement les caractéristiques finales du produit fini. Par conséquent, leur composition totale, y compris quantitative, devrait être réglementée séparément au stade de la production. Examinons plus en détail l'influence de chaque élément sur les caractéristiques des produits finaux en cuivre.
- Oxygène. L'un des éléments les plus indésirables pour tout matériau, pas seulement le cuivre. Avec sa croissance, des qualités telles que la ductilité et la résistance aux processus de corrosion se détériorent. Sa teneur ne doit pas dépasser 0,008 %. Au cours du traitement thermique, à la suite des processus d'oxydation, la teneur quantitative de cet élément diminue.
- Nickel. Forme une solution stable et réduit considérablement la conductivité.
- Soufre ou sélénium. Les deux composants ont le même effet sur la qualité produits finis. Une concentration élevée de tels événements réduit les propriétés plastiques des produits en cuivre. Le contenu de ces composants ne doit pas dépasser 0,001% de masse totale.
- Bismuth. affecte négativement la mécanique et caractéristiques technologiques produits finis. La teneur maximale ne doit pas dépasser 0,001 %.
- Arsenic. Il ne change pas de propriétés, mais forme une solution stable, est une sorte de protecteur contre les effets nocifs d'autres éléments, tels que l'oxygène, l'antimoine ou le bismuth.
- Manganèse. Il est capable de se dissoudre complètement dans le cuivre presque à température ambiante. Affecte la conductivité du courant.
- Antimoine. Le composant se dissoudra le mieux dans le cuivre, lui causant un minimum de dommages. Sa teneur ne doit pas dépasser 0,05 % en poids de cuivre.
- Étain. Forme une solution stable avec le cuivre et améliore ses propriétés de conduction thermique.
- Zinc. Son contenu est toujours minime, il n'a donc pas un tel effet néfaste.
Phosphore. Le principal désoxydant du cuivre dont la teneur maximale à une température de 714°C est de 1,7 %.
Un alliage à base de cuivre additionné de zinc est appelé laiton. Dans certaines situations, l'étain est ajouté dans de plus petites proportions. James Emerson en 1781 a décidé de breveter la combinaison. La teneur en zinc de l'alliage peut varier de 5 à 45 %. Le laiton se distingue en fonction de l'objectif et de la spécification :
- simple, composé de deux composants - cuivre et zinc. Le marquage de ces alliages est indiqué par la lettre "L", qui signifie directement la teneur en cuivre de l'alliage en pourcentage ;
- laitons multi-composants - contiennent de nombreux autres métaux, selon l'utilisation prévue. De tels alliages augmentent les propriétés opérationnelles des produits, ils sont également désignés par la lettre "L", mais avec l'ajout de chiffres.
Les propriétés physiques du laiton sont relativement élevées, la résistance à la corrosion est moyenne. La plupart des alliages ne sont pas critiques aux basses températures, il est possible de faire fonctionner le métal dans diverses conditions.
La technologie de production du laiton interagit avec les processus des industries du cuivre et du zinc, le traitement des matières premières secondaires. Façon efficace la fusion est l'utilisation d'un four électrique de type à induction avec une sortie magnétique et un contrôle de la température. Après avoir obtenu une masse homogène, il est coulé dans des moules et soumis à des processus de déformation.
L'utilisation du matériau dans diverses industries augmente sa demande chaque année. L'alliage est utilisé dans la construction de courts et la production de munitions, de diverses douilles, d'adaptateurs, de boulons, d'écrous et de matériaux de plomberie.
Les métaux non ferreux pour la fabrication de produits de différents types ont commencé à être utilisés depuis l'Antiquité. Ce fait est confirmé par les matériaux trouvés lors des fouilles archéologiques. La composition du bronze était à l'origine riche en étain.
L'industrie produit un nombre différent de variétés de bronze. Un artisan expérimenté est capable de déterminer son objectif par la couleur du métal. Cependant, tout le monde ne peut pas déterminer la marque exacte du bronze, le marquage est utilisé pour cela. Les méthodes de production de bronze sont divisées en fonderie, lors de la fusion et de la coulée, et déformable.
La composition du métal dépend de l'utilisation prévue. L'indicateur principal est la présence de béryllium. La concentration accrue de l'élément dans l'alliage, soumis à la procédure de trempe, peut concurrencer les aciers à haute résistance. La présence d'étain dans la composition enlève la flexibilité et la ductilité du métal.
La production d'alliages de bronze a évolué depuis l'Antiquité en introduisant en fait équipement moderne. La technologie utilisant le charbon de bois comme fondant est encore utilisée aujourd'hui. Séquence d'obtention du bronze :
- le four est chauffé à la température requise, après quoi le creuset y est installé;
- après fusion, le métal peut s'oxyder, pour éviter cela on ajoute du fondant sous forme de charbon de bois ;
- le cuivre phosphorique sert de catalyseur acide, l'ajout se produit après que l'alliage est complètement chauffé.
fonte du bronze
Les bronzes antiques sont soumis à des processus naturels - la patine. Une couleur verdâtre avec une teinte blanche apparaît en raison de la formation d'un film qui enveloppe le produit. Les méthodes de patination artificielle comprennent des méthodes utilisant du soufre et un chauffage parallèle à une certaine température.
Point de fusion du cuivre
Le matériau fond à une certaine température, qui dépend de la présence et de la quantité d'alliages dans la composition.
Dans la plupart des cas, le processus se déroule à une température de 1085°. La présence d'étain dans l'alliage donne un run, la fusion du cuivre peut débuter à 950°. Le zinc dans la composition abaisse également la limite inférieure à 900°.
Pour des calculs de temps précis, vous avez besoin d'un graphique de la fusion du cuivre. Sur une feuille de papier ordinaire, un graphique est utilisé, où le temps est marqué horizontalement et les degrés sont marqués verticalement. Le graphique doit indiquer à quels points la température est maintenue pendant le chauffage pour le processus de cristallisation complet.
Faire fondre du cuivre à la maison
À la maison, les alliages de cuivre peuvent être fondus de plusieurs manières. Lorsque vous utilisez l'une des méthodes, vous aurez besoin de matériel connexe :
- creuset - plats en cuivre durci ou autre métal réfractaire;
- charbon de bois, nécessaire comme fondant ;
- crochet en métal;
- forme du futur produit.
L'option la plus simple pour la fusion est le four à moufle. Des morceaux de matériau tombent dans le conteneur. Après avoir réglé la température de fusion, le processus peut être observé à travers une fenêtre spéciale. La porte installée vous permet de retirer le film d'oxyde formé au cours du processus. Pour cela, vous avez besoin d'un crochet métallique pré-préparé.
La deuxième façon de faire fondre à la maison est d'utiliser un chalumeau ou un cutter. Propane - une flamme à oxygène est parfaite pour travailler avec du zinc ou de l'étain. Des morceaux de matériaux pour le futur alliage sont placés dans un creuset et chauffés par le maître avec des mouvements arbitraires. Le point de fusion maximal du cuivre peut être atteint lors de l'interaction avec une flamme bleue.
Faire fondre du cuivre à la maison implique de travailler à des températures élevées. La sécurité est une priorité. Avant toute intervention, vous devez porter des gants de protection ignifuges et des vêtements serrés qui recouvrent entièrement le corps.
Valeur de densité de cuivre
La densité est le rapport de la masse au volume. Il est exprimé en kilogrammes par mètre cube de volume total. Du fait de l'hétérogénéité de la composition, la valeur de densité peut varier en fonction du pourcentage d'impuretés. Puisqu'il existe différentes marques de cuivre laminé avec différentes teneurs en composants, leur densité sera également différente. La densité du cuivre peut être trouvée dans des tableaux techniques spécialisés, qui est égale à 8,93x10 3 kg / m 3. Il s'agit d'une valeur de référence. Ces tableaux montrent gravité spécifique cuivre, qui est égal à 8,93 g / cm 3. Tous les métaux ne sont pas caractérisés par une telle coïncidence des valeurs de densité et de ses indicateurs de poids.
Ce n'est un secret pour personne que la masse finale du produit fabriqué dépend directement de la densité. Cependant, pour les calculs, il est beaucoup plus correct d'utiliser la gravité spécifique. Cet indicateur est très important pour la production de produits à partir de cuivre ou de tout autre métal, mais s'applique davantage aux alliages. Il s'exprime par le rapport de la masse de cuivre au volume de l'ensemble de l'alliage.
Calcul de la gravité spécifique
Actuellement, les scientifiques ont développé un grand nombre de méthodes pour aider à trouver les caractéristiques de la densité du cuivre, qui permettent même sans recourir à des tables spécialisées de calculer cet indicateur important. Le sachant, vous pouvez facilement choisir matériaux nécessaires, grâce à quoi, à la fin, vous pouvez obtenir la pièce souhaitée avec les paramètres requis. Cela se fait au stade de la préparation, lorsqu'il est prévu de créer la pièce nécessaire à partir de cuivre ou de ses alliages.
Comme mentionné ci-dessus, la gravité spécifique du cuivre peut être consultée dans un ouvrage de référence spécialisé, mais si elle n'est pas à portée de main, elle peut être calculée à l'aide de la formule suivante : nous divisons le poids par volume et obtenons la valeur dont nous avons besoin. En termes généraux, ce rapport peut être exprimé comme la valeur totale du poids à la valeur totale du volume du produit entier.
Ne le confondez pas avec le concept de densité, car il caractérise le métal d'une manière différente, bien qu'il ait les mêmes valeurs des indicateurs.
Considérez comment la gravité spécifique peut être calculée si la masse et le volume du produit en cuivre sont connus.
Par exemple, nous avons une feuille de cuivre propre de 5 mm d'épaisseur, 2 m de large et 1 m de long, calculons d'abord son volume : 5 mm * 1000 mm (1 m = 1000 mm) * 2000 mm, soit 10 000 000 mm 3 ou 10 000 cm3. Pour la commodité des calculs, nous supposerons que la masse de la feuille est de 89 kg 300 grammes ou 89300 grammes. Nous divisons le résultat calculé par le volume et obtenons 8,93 g / cm 3. Connaissant cet indicateur, on peut toujours facilement calculer la teneur pondérale en cuivre d'un alliage particulier. Ceci est pratique, par exemple, pour le traitement des métaux.
Unités de gravité spécifique
Différents systèmes de mesure utilisent différentes unités pour indiquer la gravité spécifique du cuivre :
- Le système CGS ou centimètre-gramme-seconde utilise dyne/cm3.
- Le SI international utilise des unités de N/m 3 .
- Dans le système MKSS ou mètre-kilogramme-seconde-bougie, kg / m 3 est utilisé.
Les deux premiers indicateurs sont égaux l'un à l'autre et le troisième, une fois converti, est de 0,102 kg / m 3.
Calcul du poids à l'aide des valeurs de gravité spécifique
N'allons pas loin et utilisons l'exemple décrit ci-dessus. Calculez la teneur totale en cuivre de 25 feuilles. Changeons la condition et supposons que les feuilles sont en alliage de cuivre. Ainsi, nous prenons la densité du cuivre du tableau et elle est égale à 8,93 g / cm 3. L'épaisseur de la feuille est de 5 mm, la surface (1000 mm * 2000 mm) est de 2 000 000 mm, respectivement, le volume sera de 10 000 000 mm 3 ou 10 000 cm 3. Maintenant, nous multiplions la gravité spécifique par le volume et nous obtenons 89 kg et 300 gr. Nous avons calculé la quantité totale de cuivre contenue dans ces feuilles sans tenir compte du poids des impuretés elles-mêmes, de sorte que la valeur du poids total pourrait être plus élevée.
Maintenant, nous multiplions le résultat calculé par 25 feuilles et obtenons 2 235 kg. De tels calculs sont appropriés à utiliser lors du traitement de pièces en cuivre, car ils vous permettent de déterminer la quantité de cuivre contenue dans les objets d'origine. De même, les barres de cuivre peuvent être calculées. La section transversale du fil est multipliée par sa longueur, où nous obtenons le volume de la barre, puis par analogie avec l'exemple ci-dessus.
Comment la densité est déterminée
La densité du cuivre, comme la densité de toute autre substance, est une valeur de référence. Elle s'exprime par un rapport masse sur volume. Il est très difficile de calculer cet indicateur par vous-même, car il est impossible de vérifier la composition sans appareils spéciaux.
Exemple de calcul de densité de cuivre
L'indicateur est exprimé en kilogrammes par mètre cube ou en grammes par centimètre cube. La densité est plus utile pour les fabricants qui, sur la base des données disponibles, peuvent composer une pièce particulière avec les propriétés et caractéristiques requises.
Domaines d'utilisation du cuivre
En raison de ses propriétés physiques et mécaniques, il est largement utilisé dans diverses industries. On le trouve le plus souvent dans le domaine électrique comme partie intégrante de fil électrique. Il est également populaire dans la production de systèmes de chauffage et de refroidissement, d'électronique et de systèmes d'échange de chaleur.
Dans l'industrie de la construction, il est principalement utilisé pour créer divers types de structures, qui sont obtenues beaucoup moins en masse qu'à partir de tout autre matériau similaire. Il est souvent utilisé pour les toitures, car ces produits sont légers et ductiles. Un tel matériau est facilement traité et vous permet de modifier la géométrie du profil, ce qui est très pratique.
Comme mentionné ci-dessus, il trouve sa principale application dans la fabrication de câbles électriques et autres câbles conducteurs, où il est utilisé pour la fabrication d'âmes de fils et de câbles. Possédant une bonne conductivité électrique, il offre une résistance suffisante aux électrons du courant.
Les alliages de cuivre sont également largement utilisés, par exemple, un alliage de cuivre et d'or augmente parfois la résistance de ce dernier.
Les dépôts de sel ne se forment jamais sur les parois des barres de cuivre. Cette qualité est utile pour le transport de liquides et de vapeurs.
À base d'oxydes de cuivre, des supraconducteurs sont obtenus et, sous leur forme pure, ils sont utilisés pour fabriquer des alimentations galvaniques.
Il fait partie du bronze, qui résiste aux environnements agressifs, comme l'eau de mer. Par conséquent, il est souvent utilisé dans la navigation. De plus, les produits en bronze peuvent être vus sur les façades des maisons, comme élément de décoration, car un tel alliage est facilement traité, car il est très plastique.
Synonymes : Les mélanges minces de cuivre natif et de cuprite étaient appelés cuprocuprite (Vernadsky, 1910). La Whitneyite (Gent, 1859) et la Darwinite (Forbes, 1860) sont du cuivre arsenic qui forme des mélanges avec l'algodonite.
origine du nom
Le nom latin du cuivre cuprum vient du nom de l'île de Chypre, d'où le cuivre était importé dans les temps anciens. L'origine du nom russe n'est pas claire.
Le nom anglais du minéral Cuivre est Cuivre
- Composition chimique
- Variétés
- Forme d'être dans la nature
- Propriétés physiques
- Propriétés chimiques. Autres propriétés
- signes diagnostiques. Satellites.
- Origine du minéral
- Lieu de naissance
- Utilisation pratique
- Acheter
Formule
Composition chimique
Il contient parfois des mélanges de Fe, Ag, Pb, Au, Hg, Bi, Sb, V, Ge 3 (argent cuivre avec 3-4% Ag, fer-2,5% Fe et or-2-3% Au). Les impuretés sont plus souvent observées dans le cuivre natif primaire ; le cuivre recyclé est généralement plus pur. La composition du cuivre natif du gisement de Shamlugh (Arménie): Cu - 97,20 -97,46%, Fe - 0,25%; dans le cuivre des gisements de l'Altaï, 98,3% Cu et plus ont été déterminés.
Caractéristique cristallographique
Syngonie. Cubique.
Classe. Hexoctaédrique.
Structure en cristal
La structure cristalline est caractérisée par un réseau à faces centrées ; les atomes de cuivre sont situés aux coins et au centre des faces du cube élémentaire. Il s'agit d'une expression formelle du fait que dans la structure du cuivre, il existe un empilement le plus proche (appelé empilement cubique le plus proche) d'atomes métalliques avec un rayon de 1,27 A et une distance entre les atomes les plus proches de 2,54 A tout en remplissant un espace de 74,05 %. Chaque atome de Cu est entouré de 12 semblables (numéro de coordination 12), situés autour de lui le long des sommets du soi-disant cuboctaèdre d'Archimède.
Principaux formulaires:a (100), d (110), o (111), l (530), e (210), h (410).
Forme d'être dans la nature
Forme de cristal. La forme des cristaux est cubique, tétrahexaédrique, dodécaédrique, moins souvent - octaédrique (éventuellement, pseudomorphes après cuprite). Les bords sont souvent rugueux, avec des dépressions ou des élévations. Les cristaux simples sont rares.
Double. Les macles d'intercroissance le long de (111) sont courantes, parfois polysynthétiques, souvent lamellaires dans le sens axial des macles ou macles planes allongées parallèles à la diagonale. Habituellement, les cristaux (simples et jumeaux) sont inégalement développés : allongés, raccourcis ou déformés. Les formes dendritiques sont caractéristiques, qui sont des intercroissances uniformes de nombreux cristaux (uniformément déformés ou réguliers) dans n'importe quelle direction. Il s'agit par exemple de cristaux maclés selon (111) allongés selon l'axe de symétrie d'ordre 2 et fusionnés parallèlement aux faces d'un dodécaèdre rhombique) ou d'intercroissances de cristaux macles réguliers se ramifiant le long des arêtes et des diagonales de faces octaédriques, ainsi que de cristaux parallèles intercroissances de cristaux allongés dans les axes de direction du 4ème ordre. Dans les précipités continus de cuivre natif lors de la gravure, des signes de cristallisation collective sont trouvés avec le développement de gros grains dus à des grains zonaux plus petits et de forme irrégulière.
Agrégats. Cristaux déformés, en grains simples irréguliers, intercroissances dendritiques, formations filamenteuses, filiformes, moussues, plaques minces, concrétions, accumulations pulvérulentes et masses continues pesant jusqu'à plusieurs centaines de tonnes.

Propriétés physiques
Optique
La couleur de la fracture fraîche est rose clair, virant rapidement au rouge cuivré, puis au brun; souvent avec une teinte jaune ou panachée.
La ligne est cuivrée, brillante.
Métallisé brillant.
Transparence. Opaque. Dans les assiettes les plus fines, il transparaît en vert.
Indices de réfraction
Ng = , Nm = et Np =
Mécanique
Dureté 2,5-3.
Densité 8.4-8.9
Le clivage n'est pas observé.
Eclat de fracture, crochu.
Propriétés chimiques
Facilement soluble dans HNO 3 dilué et dans l'eau régale, dans H 2 SO 4 - lorsqu'il est chauffé, dans HCl - avec difficulté. Il se dissout dans une solution aqueuse d'ammoniac, le rendant bleu. Dans les sections polies, il peut être gravé avec tous les principaux réactifs. Structure interne facilement détecté avec NH 4 OH + H 2 O 2 ou Hcl + CrO 3 (solution à 50%).
Autres propriétés
Très malléable et ductile. La conductivité électrique est très élevée ; considérablement réduit par les impuretés. 
Comportement au chauffage. Pur cuivre fond à 1083°. La conductivité thermique est légèrement inférieure à celle de l'argent.
Production artificielle du minéral.
Il peut être facilement obtenu à partir de masses fondues ou par électrolyse à partir de solutions de sels de cuivre.
Fonctionnalités diagnostiques
Minéraux similaires
Reconnu par la couleur rouge de la surface fraîche, la ligne brillante, la dureté et la malléabilité moyennes, généralement recouvertes de dépôts verdâtres, noirs et bleus de minéraux de cuivre oxydés. Sous un microscope en lumière réfléchie, il est facilement déterminé par la couleur et la réflectivité.
Minéraux associés. Or cuivreux, chalcocite, calcite, diopside, apatite, sphène, magnétite, malachite, barytine, quartz, chalcopyrite.
Origine et emplacement
Hydrothermale. S'accumule dans les placers. Les pépites pesant jusqu'à 450 tonnes sont décrites comme des phénomènes uniques.
Le cuivre natif se forme dans des conditions réductrices au cours de divers processus géologiques ; une partie importante de celui-ci est rejetée par les solutions hydrothermales. Sous forme de ségrégations microscopiques, on l'observe dans de nombreuses roches ignées, principalement mafiques, exposées à des solutions hydrothermales, par exemple dans les péridotites serpentinisées, les dunites et les serpentinites. Dans ce cas, l'apparition de cuivre natif est peut-être associée à la décomposition de sulfures de cuivre précédemment formés, par exemple la cubanite (Oural, Transcaucasie). Une origine similaire peut être attribuée au cuivre natif dans les roches basiques amphibolisées de la région de Serov. Région de Sverdlovsk. Dans le gisement d'or cuivreux de Karabash de la région de Tcheliabinsk, du cuivre natif est observé dans des corps filoniens de roches diopside-grenat parmi les serpentinites; pour cuivre natif il se caractérise par une association avec l'or cuivreux, la chalcocite, la calcite, le diopside, l'apatite, le sphène, la magnétite, etc.
Dans certaines roches volcaniques anciennes (mélafirs, diabases, etc.), métamorphosées sous l'influence des vapeurs, des gaz et des solutions hydrothermales, le cuivre comble les amygdales, cimente entre les minéraux des laves altérées, comble les vides et les fissures ; accompagnés de minéraux hydrothermaux : analcime, lomontite, préhnite, datolite, adulaire, chlorite, épidote, pumpeliite, quartz, calcite. Les plus grands gisements de ce type sont situés sur la péninsule de Kivino dans la région du lac Supérieur (Michigan, États-Unis), où la minéralisation est confinée à la séquence du Protérozoïque supérieur. La masse principale de cuivre est extraite des mélafirs et des conglomérats, mais les plus grandes ségrégations de cuivre (jusqu'à 400 tonnes et plus) se trouvent dans les veines de calcite contenant de l'argent natif et de la dômeikite.

Changement minéral.
Les produits d'altération les plus courants du cuivre natif sont la cuprite, la malachite et l'azurite.
Lieu de naissance
Des allocations de cuivre natif ont été observées dans les diabases de Novaya Zemlya, dans les pièges de la plate-forme sibérienne, parmi les principales roches effusives en Italie, aux îles Féroé (Danemark), en Nouvelle-Écosse (Canada) et ailleurs. Les représentants de types rares de gisements hypogènes de cuivre natif sont le gisement de zinc-manganèse Franklin (New Jersey, États-Unis) et les gisements de manganèse Longban et Jacobsberg (Suède). Hypogénique, apparemment, est l'allocation de cuivre natif pesant jusqu'à plusieurs tonnes du gisement de Kalmaktas précédemment développé au Kazakhstan, présenté dans les musées avec d'excellents échantillons.
Dans la zone d'oxydation, en particulier dans ses parties inférieures, le cuivre natif est principalement un produit précoce de l'altération des minéraux sulfurés de cuivre, principalement la chalcocite. Il compose principalement des décharges de forme irrégulière, moins souvent - des cristaux et des agrégats dendritiques.
Le plus souvent, le cuivre natif est accompagné de chalcocite, cuprite, calcite et limonite. Il est observé dans un certain nombre de gisements au Kazakhstan (Dzhezkazgan, Berkara, Uspenskoye, etc.), Rudny Altai (Belousovskoye, Zyryanovskoye, Chudak, Talovskoye, etc.), aux États-Unis (Bisbee et Clifton-Morensee en Arizona, Tintik en Utah , etc...) .
Une partie du cuivre natif dans la zone d'oxydation est formée par dépôt à partir de solutions contenant du sulfate de cuivre. Tel est par exemple le cuivre natif, qui forme des précipités dans des cavités au milieu d'agrégats de limonite, parfois en association avec de la cuprite (gisement de minerai de cuivre, région de Sverdlovsk, etc.). Des pseudomorphes de cuivre natif sont connus, formés dans la zone d'oxydation après la chalcocite, la cuprite, l'antlérite, la chalcanthite, l'azurite, la calcite, l'aragonite et d'autres minéraux.
De particulièrement beaux échantillons de cuivre natif (cristaux et agrégats dendritiques) proviennent des mines de Turin de la région de Sverdlovsk.
Dans certains chantiers miniers, le soi-disant cuivre de ciment est libéré des eaux contenant du cuivre sur des objets en fer sous forme de films et de croûtes. Il existe également des cas connus de formation de cuivre sur des restes de fixations à moitié décomposés.
En quantité accrue, le cuivre natif est observé dans certaines roches sédimentaires (grès, argiles, marnes) contenant des restes végétaux, sous forme de ségrégations de forme irrégulière, parfois en pseudomorphes sur bois ou sous forme de concrétions. Tels sont, par exemple, les grès cuprifères du Permien de certaines régions de Russie (Oural, Tatarstan, etc.), les grès de Naukata au Kirghizstan, les grès cuivreux du Crétacé de Korokoro et Kobritsos en Bolivie, etc.
La formation de cuivre natif dans certaines tourbières est également associée aux processus de récupération, par exemple dans la région de Sverdlovsk - le long de la rivière Lyovikha dans le bassin de la rivière Tagil et dans la région de Sysert.
Sous forme de cailloux et de grains, le cuivre natif se trouve en Russie dans certains placers: dans l'Oural, le long du Yenisei, le long de la rivière B. Sarkhoy en Bouriatie, le long de la rivière Chorokh en Géorgie, sur les îles Commander et ailleurs . Dans l'état du Connecticut (USA), le cuivre natif a été trouvé dans les dépôts glaciaires sous forme de ségrégations pesant jusqu'à 75 kg. De petits précipités de forme irrégulière de cuivre natif sont notés dans le fer natif de la météorite Vengerovo en association avec la troïlite.

Utilisation pratique
Important composant certains minerais de cuivre, parfois le principal minerai de cuivre de ces minerais.
Il est utilisé dans l'électrotechnique, la fabrication d'instruments; divers alliages avec du cuivre (bronze, laiton, cupronickel) sont largement utilisés.
Méthodes de recherche physique
Analyse thermique différentielle
Lignes principales sur les radiographies :
méthodes anciennes. Il fond sous le chalumeau. À une température de chaleur blanche, il s'oxyde progressivement, rendant la flamme verte.
Render(( blockId : "R-A-248885-7", renderTo : "yandex_rtb_R-A-248885-7", async : true )); )); t = d.getElementsByTagName("script"); s = d.createElement("script"); s.type="texte/javascript" ; s.src = "//an.yandex.ru/system/context.js" ; s.async = vrai ; t.parentNode.insertBefore(s, t); ))(this, this.document, "yandexContextAsyncCallbacks");
Propriétés optiques cristallines dans les préparations minces (coupes)
Dans les sections polies en rose clair réfléchi. Réflectivité (en%) : pour les rayons verts - 61, pour l'orange - 83, pour le rouge - 89. Isotrope. Indices de réfraction (selon Kundt) dans les prismes pour la lumière rouge - 0,45, pour le blanc - 0,65, pour le bleu - 0,95 ; en lumière réfléchie (selon Drude) pour la lumière Na 0,641, pour le rouge - 0,580. Le coefficient d'absorption pour la lumière Na est de 4,09, pour la lumière rouge - 5,24.



 Cuivre. Somorodok
Cuivre. Somorodok a) Densité et dureté.
Les métaux du sous-groupe du cuivre, comme les métaux alcalins, ont un électron libre par atome d'ion métallique. Il semblerait que ces métaux ne devraient pas différer beaucoup des métaux alcalins. Mais contrairement aux métaux alcalins, ils ont des points de fusion plutôt élevés. La grande différence de températures de fusion entre les métaux de ces sous-groupes s'explique par le fait qu'il n'y a presque pas d'espace libre entre les atomes d'ion des métaux du sous-groupe du cuivre et qu'ils sont situés plus près. En conséquence, le nombre d'électrons libres par unité de volume, la densité électronique, ils en ont plus. Par conséquent, la force de la liaison chimique qu'ils ont plus. Par conséquent, les métaux du sous-groupe du cuivre fondent et bouillent à des températures plus élevées.
Les métaux du sous-groupe du cuivre ont, par rapport aux métaux alcalins, une plus grande dureté. Cela s'explique par une augmentation de la densité électronique et une disposition plus dense des atomes dans le réseau cristallin. Il convient de noter que la dureté et la résistance des métaux dépendent de la disposition correcte des atomes d'ions dans le réseau cristallin. Dans les métaux que nous rencontrons pratiquement, il existe différents types de violations de la disposition correcte des atomes d'ions, par exemple des vides dans les nœuds du réseau cristallin. De plus, le métal est constitué de petits cristaux (cristallites), entre lesquels la liaison est affaiblie. À l'Académie des sciences de l'URSS, le cuivre a été obtenu sans perturbation dans le réseau cristallin. Pour ce faire, du cuivre très pur a été sublimé à haute température dans un vide profond sur un substrat profond. Le cuivre a été obtenu sous forme de petits fils - "moustaches". Il s'est avéré que ce cuivre est cent fois plus résistant que le cuivre ordinaire.
b) La couleur du cuivre et de ses composés.
Le cuivre pur a une autre caractéristique intéressante. La couleur rouge est due aux traces d'oxygène qui y sont dissoutes. Il s'est avéré que le cuivre sublimé à plusieurs reprises dans le vide (en l'absence d'oxygène) a une couleur jaunâtre. Le cuivre à l'état poli a un fort éclat.
Avec une augmentation de la valence, la couleur du cuivre et de ses composés s'assombrit, par exemple, CuCl- blanche, Cu 2 O- rouge, CuCl + H 2 O- bleu, CuO- le noir. Les carbonates sont caractérisés par des couleurs bleues et vertes, en fonction de la teneur en eau, ce qui est une caractéristique pratique intéressante pour la recherche.
c) Conductivité électrique.
Le cuivre a la conductivité électrique la plus élevée (après l'argent), ce qui explique son utilisation intensive en électronique.
d) Réseau cristallin.
Le cuivre cristallise sous la forme d'un cube centralisé (Fig. 1).
Figure 1. Réseau cristallin de cuivre.
e) Isotopes.
Le cuivre naturel est constitué de deux isotopes stables, 63 Cu et 65 Cu, avec des abondances de 69,1 et 30,9 % atomiques, respectivement. Plus de deux douzaines d'isotopes instables sont connus, dont le plus long est le 67 Cu avec une demi-vie de 62 heures.
§4. alliages de cuivre.
Les alliages de cuivre sont les premiers alliages métalliques créés par l'homme. Jusqu'au milieu du XXe siècle environ. dans la production mondiale, les alliages de cuivre occupaient la 1ère place parmi les alliages de métaux non ferreux, puis la perdaient au profit des alliages d'aluminium. Avec de nombreux éléments formes de cuivre vastes domaines solutions solides substitutionnelles dans lesquelles des atomes additifs prennent la place des atomes de cuivre dans un réseau cubique à faces centrées. Le cuivre à l'état solide dissout jusqu'à 39 % de Zn, 15,8 % de Sn, 9,4 % d'Al et de Ni - de manière illimitée. Avec la formation d'une solution solide à base de cuivre, sa résistance et sa résistance électrique augmentent, le coefficient de température de la résistance électrique diminue, la résistance à la corrosion peut augmenter de manière significative et la ductilité reste à un niveau assez élevé.
Actuellement, il existe d'innombrables alliages à base de cuivre, je vais donner ici les trois alliages les plus basiques et les plus courants dans la technologie et la vie quotidienne :
a) laiton
Le laiton est un alliage de cuivre additionné de zinc. Le zinc, dont la teneur dans la composition peut atteindre jusqu'à 40%, augmente la résistance et la ductilité de l'alliage. Le laiton le plus ductile, avec une teneur en zinc d'environ 30 %. Il est utilisé pour la production de fils et de tôles minces. La composition peut également comprendre du fer, de l'étain, du plomb, du nickel, du manganèse et d'autres composants. Ils augmentent la résistance à la corrosion et les propriétés mécaniques de l'alliage. Le laiton est bien traité : soudage et laminage, parfaitement poli. Une large gamme de propriétés, un faible coût, une facilité de traitement et une belle couleur jaune font du laiton l'alliage de cuivre le plus courant avec une large gamme d'applications.
b) Bronze
Les bronzes sont un alliage de cuivre, généralement avec de l'étain comme principal composant d'alliage, mais les bronzes comprennent également des alliages de cuivre avec de l'aluminium, du silicium, du béryllium, du plomb et d'autres éléments, à l'exception du zinc (c'est du laiton) et du nickel. En règle générale, tout bronze contient de petites quantités d'additifs : zinc, plomb, phosphore, etc.
Les gens ont appris à fondre le bronze à l'étain traditionnel au début de l'âge du bronze et pendant très longtemps, il a été largement utilisé ; même avec l'avènement de l'âge du fer, le bronze n'a pas perdu de son importance (en particulier, jusqu'au XIXe siècle, les armes à feu étaient en bronze à canon)
Les bronzes les plus utilisés sont : les bronzes au silicium, les bronzes au béryllium, les bronzes au silicium, les bronzes au chrome, mais de loin le plus connu et le plus applicable est le bronze à l'étain.
c) Alliages cuivre-nickel
Alliages à base de cuivre contenant du nickel comme élément d'alliage principal - Melchior, argent allemand (alliage de cuivre avec 5-35% Ni et 13-45% Zn). Le nickel forme une série continue de solutions solides avec le cuivre. Lorsque du nickel est ajouté au cuivre, sa résistance et sa résistance électrique augmentent, le coefficient de température de la résistance électrique diminue et la résistance à la corrosion est considérablement augmentée. Les alliages cuivre-nickel fonctionnent bien à chaud et à froid.
Le cuivre est un métal qui appartient au groupe des non ferreux, car il a une couleur rose rougeâtre brillante, avec divers degrés de traitement, il peut avoir une teinte brune, verte et dorée. Ce métal a des propriétés électrolytiques, une conductivité thermique, une résistance et une élasticité élevées. Le cuivre est facile à traiter, fait partie de nombreux alliages, augmentant ainsi sa composition chimique et propriétés physiques. Les alliages les plus connus sont le bronze - 7 à 10% d'étain sont ajoutés à la masse de cuivre, un alliage cuivre-nickel - constantes (dans la masse totale jusqu'à 40% de nickel) et le manganin (le nickel et le manganèse sont inclus dans l'alliage) . La présence d'un grand nombre de caractéristiques distinctives et la disponibilité du métal déterminent l'utilisation généralisée du cuivre dans diverses industries, agriculture, bâtiment, médecine.
Comment le cuivre est utilisé dans l'industrie

Le cuivre est fondu dans l'industrie
Dans la fabrication de divers produits, j'utilise le cuivre sous sa forme pure et sous forme d'alliages avec divers métaux. Le métal pur est utilisé pour fabriquer câbles réseau et fils électriques. Le cuivre se caractérise par sa capacité à conduire l'électricité rapidement et sans perte. Selon cet indicateur, il vient juste après l'argent, mais comme il appartient aux métaux précieux et a un coût élevé, l'utilisation du cuivre est préférée dans le câblage électrique. Seul du métal pur est utilisé pour la production de l'âme du câble - âme en cuivre, la présence d'éventuelles impuretés réduit considérablement l'effet conducteur. Pour obtenir du cuivre pur, ses ébauches sont soumises au processus d'électroraffinage. C'est l'immersion du métal dans un bain rempli d'une solution de sulfate de cuivre, et une électrode reliée à l'électricité y est immergée. Les ions métalliques se déplacent vers l'électrode et les particules d'impuretés s'accumulent près de l'anode, de sorte qu'elles peuvent être éliminées, et la sortie est un matériau avec une teneur en cuivre pur à 99,999 %.
Les alliages cuivre-nickel se caractérisent par une résistance électrique élevée et sont utilisés dans la fabrication d'instruments. Ces alliages résistent à la corrosion, ne s'effondrent pas même dans l'eau de mer. Un alliage dans lequel 40% de zinc est appelé laiton, il a une résistance accrue, et son faible coût conduit à une utilisation généralisée :

- en génie mécanique;
- dans la production de biens ménagers;
- dans l'industrie chimique.
Fabriqué en laiton :
- tuyaux;
- radiateurs;
- manches;
- accessoires automobiles et plus encore.
Le cuivrage est utilisé pour le chromage de l'acier. Les produits en acier sont souvent recouverts de chrome ou de nickel à des fins décoratives, mais ce revêtement est de courte durée et peut tomber pendant le fonctionnement, afin d'éviter cela, un revêtement de cuivre est appliqué entre l'acier et la couche de chrome, il offre une meilleure adhérence.
L'utilisation du cuivre dans l'industrie peut également être observée lors de la soudure, cela facilite grandement ce processus, et la pièce est homogène et durable. Ce métal est assez ductile, il peut être utilisé pour la fabrication de conduites d'eau de différentes configurations. En Russie, l'utilisation de telles conduites n'est pas répandue, mais en Europe, de tels produits peuvent être trouvés assez souvent.
Les produits en cuivre au quotidien
Ce métal n'est pas seulement utilisé pour la production de biens industriels, les produits en cuivre se retrouvent également dans la vie de tous les jours :
Tous ces articles peuvent être trouvés dans presque toutes les maisons.
Un rôle important dans l'agriculture est joué par les engrais du sol contenant vitriol bleu- il stimule la croissance active de diverses cultures, les protège des ravageurs, des arbres, des arbustes, les graines sont traitées avec une solution de vitriol.
Articles d'intérieur en cuivre
Lors de la construction de maisons, des tôles de cuivre sont utilisées pour la toiture. Il est connu que métal donné résistant à divers phénomènes atmosphériques, sous leur influence se forme une couche protectrice - la patine, qui a une teinte verdâtre. La patine empêche la corrosion du métal et un toit avec un tel revêtement peut servir longtemps.
pièces de cuivre
La galvanoplastie peut également être attribuée à la portée du cuivre, elle est connue depuis 1873. La galvanoplastie est un art particulier basé sur le dépôt électrolytique de métal dans une solution saline aqueuse. Cette méthode a longtemps dépassé l'art et est utilisée dans industrie spatiale, aéronautique, génie mécanique. Son essence réside dans le fait que le modèle créé du produit, par exemple à partir de gypse ou de pâte à modeler, est métallisé, après avoir retiré le modèle, il ne reste que la forme métallique. Le processus de métallisation se produit en appliquant une fine couche de métal sur la disposition, le graphite est plus souvent utilisé, la pièce est placée dans une solution contenant des sels de cuivre. La disposition joue le rôle d'une cathode et attire les particules métalliques, qui formeront plus tard la forme du produit fini.
L'utilisation du cuivre en médecine
La médecine traditionnelle considère le cuivre comme un élément très important dans la vie humaine. Dans le corps, cette substance est contenue à raison de 2 * 10 -4% de la masse totale. Chaque jour, une personne consomme jusqu'à 60 mg de cuivre avec de la nourriture, dont environ 2 mg sont absorbés, ce qui est la norme nécessaire pour un corps sain. Le cuivre joue un rôle important dans la biosynthèse de l'hémoglobine, dans le maintien du taux de sucre, de cholestérol et d'acide urique. Le cuivre est nécessaire au fonctionnement normal du système cardiovasculaire, du cerveau et du tube digestif. En cas de carence, il développe :

- pour le traitement de l'insuffisance aiguë, des médicaments contenant ce microélément sont utilisés;
- en thérapie - l'utilisation d'applications ou de bracelets métalliques.
La plus grande quantité d'oligo-éléments se trouve dans les aliments tels que :
- Champignon;
- Patate;
- Foie de morue;
- grains entiers;
- huîtres et seiches.
Dans le même temps, un excès de cuivre dans le corps, lorsque sa quantité dépasse 250 mg, entraîne une intoxication et une perturbation du foie, le développement de la maladie de Wilson, une anémie.
Vidéo : comment est fabriqué un câble en cuivre
- Désignation - Cu (Cuivre);
- Période - IV ;
- Groupe - 11 (Ib);
- Masse atomique - 63,546 ;
- Numéro atomique - 29 ;
- Rayon d'un atome = 128 pm ;
- Rayon covalent = 117 pm ;
- Répartition des électrons - 1s 2 2s 2 2p 6 3s 2 3p 6 3d 10 4s 1 ;
- t fusion = 1083,4°C;
- point d'ébullition = 2567°C;
- Electronégativité (selon Pauling / selon Alpred et Rochov) = 1,90 / 1,75 ;
- État d'oxydation : +3, +2, +1, 0 ;
- Densité (n.a.) \u003d 8,92 g / cm 3;
- Volume molaire = 7,1 cm 3 / mol.
Le cuivre (cuprum, tire son nom de l'île de Chypre, où se trouvait un grand gisement de cuivre à ciel ouvert) est l'un des premiers métaux maîtrisés par l'homme - l'âge du cuivre (l'époque où les outils en cuivre prévalaient dans la vie quotidienne) couvre la période IV-III millénaire av. e.
Un alliage de cuivre et d'étain (bronze) a été obtenu au Moyen-Orient en 3000 av. e. Le bronze était préféré au cuivre car il était plus solide et plus facile à forger.

Riz. La structure de l'atome de cuivre.
La configuration électronique de l'atome de cuivre est 1s 2 2s 2 2p 6 3s 2 3p 6 3d 10 4s 1 (voir Structure électronique des atomes). Dans le cuivre, un électron apparié du niveau s externe "saute" vers le sous-niveau d de l'orbitale pré-externe, ce qui est associé à la grande stabilité du niveau d complètement rempli. Le sous-niveau d stable terminé du cuivre détermine son inertie chimique relative (le cuivre ne réagit pas avec l'hydrogène, l'azote, le carbone, le silicium). Le cuivre dans les composés peut présenter des états d'oxydation +3, +2, +1 (les plus stables sont +1 et +2).

Riz. Configuration électronique du cuivre.
Propriétés physiques du cuivre :
- métal, rouge-rose;
- a une ductilité et une ductilité élevées;
- bonne conductivité électrique;
- faible résistance électrique.
Propriétés chimiques du cuivre
- lorsqu'il est chauffé, il réagit avec l'oxygène :
02 + 2Cu = 2CuO ; - lorsqu'il est exposé à l'air pendant une longue période, il réagit avec l'oxygène même à température ambiante :
O 2 + 2Cu + CO 2 + H 2 O \u003d Cu (OH) 2 CuCO 3; - réagit avec l'acide nitrique et sulfurique concentré :
Cu + 2H 2 SO 4 \u003d CuSO 4 + SO 2 + 2H 2 O; - le cuivre ne réagit pas avec l'eau, les solutions alcalines, l'acide chlorhydrique et l'acide sulfurique dilué.
Composés de cuivre
Oxyde de cuivre CuO(II):
- solide rouge-brun, insoluble dans l'eau, présentant des propriétés basiques;
- lorsqu'il est chauffé en présence d'agents réducteurs, il donne du cuivre libre :
CuO + H 2 \u003d Cu + H 2 O; - l'oxyde de cuivre est obtenu par l'interaction du cuivre avec l'oxygène ou la décomposition de l'hydroxyde de cuivre (II) :
02 + 2Cu = 2CuO ; Cu (OH) 2 \u003d CuO + H 2 O.
Hydroxyde de cuivre Cu (OH 2) (II):
- substance bleue cristalline ou amorphe, insoluble dans l'eau;
- se décompose en eau et en oxyde de cuivre lorsqu'il est chauffé;
- réagit avec les acides pour former les sels correspondants :
Cu(OH 2) + H 2 SO 4 = CuSO 4 + 2H 2 O; - réagit avec les solutions alcalines, formant des cuprates - composés complexes bleu vif :
Cu (OH 2) + 2KOH \u003d K 2.
Pour les composés de cuivre, voir Oxydes de cuivre .
Obtention et utilisation du cuivre
- méthode pyrométallurgique le cuivre est obtenu à partir de minerais sulfurés à haute température :
CuFeS 2 + O 2 + SiO 2 → Cu + FeSiO 3 + SO 2; - l'oxyde de cuivre est réduit en cuivre métallique par l'hydrogène, le monoxyde de carbone, les métaux actifs :
Cu 2 O + H 2 \u003d 2Cu + H 2 O;
Cu 2 O + CO \u003d 2Cu + CO 2;
Cu 2 O + Mg \u003d 2 Cu + MgO.
L'utilisation du cuivre est due à sa conductivité électrique et thermique élevée, ainsi qu'à sa ductilité :
- production de fils et câbles électriques;
- dans les équipements d'échange de chaleur ;
- en métallurgie pour obtenir des alliages : bronze, laiton, cupronickel ;
- en radioélectronique.









Flower party : un bouquet d'émotions positives
Paroles d'enseignants dans une scène de félicitations pour les parents
Qui est qui par relation Sa belle-mère appelle sa belle-mère maman
Ta mère est ma belle-mère Riddle belle-mère appelle ma belle-mère
Comment faire une scène pour un mariage "Trois filles sous la fenêtre Scène comique trois filles